题目内容
【题目】氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。
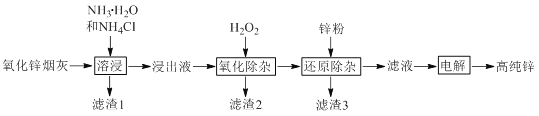
已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________。
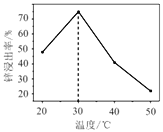
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________。
(4)“滤渣3”除锌外,主要成分为___________________。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________(写名称)。电解后的电解液经补充_________(写一种物质的化学式)后可返回至__________________(填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________。
【答案】第四周期ⅡB 低于30℃,溶浸反应速率随温度升高而增大,超过30℃,氨气逸出导致溶浸反应速率下降 2AsCl52+2H2O2+6NH3H2O=As2O5(胶体)+10Cl+6NH4++5H2O Cu、Cd 氮气 NH3或NH3H2O 溶浸 Zn(OH)1.6Cl0.4
【解析】
由流程可知,氧化锌烟灰加入氨水、氯化铵进行溶浸,溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在,加入过氧化氢,AsCl52-转化为As2O5胶体吸附聚沉除去,过滤后加入锌粉还原,可除去Cu、Cd等,滤液主要含有Zn(NH3)42+,电解可生成高纯度锌,以此解答该题。
(1)Zn的原子序数为30,其在元素周期表中的位置为第四周期ⅡB,
故答案为:第四周期ⅡB;
(2)根据温度与锌浸出率的图可知,30℃左右时浸出率最高,如低于30℃,溶浸反应速率随温度升高而增大,超过30℃,氨气逸出导致溶浸反应速率下降,
故答案为:低于30℃,溶浸反应速率随温度升高而增大,超过30℃,氨气逸出导致溶浸反应速率下降;
(3)“氧化除杂”中,AsCl52转化为As2O5胶体吸附聚沉除去,反应的离子方程式为2AsCl52+2H2O2+6NH3H2O=As2O5(胶体)+10Cl+6NH4++5H2O,
故答案为:2AsCl52+2H2O2+6NH3H2O=As2O5(胶体)+10Cl+6NH4++5H2O;
(4)锌可置换出Cu、Cd,“滤渣3”的主要成分为Cu、Cd,
故答案为:Cu、Cd;
(5)“电解”时Zn(NH3) 42+在阴极放电,发生还原反应生成锌,电极反应式为Zn(NH3) 42++2e=Zn+4NH3,阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是氮气,则电解后的电解液经补充氨气或氨水后可返回“溶浸”工序继续使用,
故答案为:氮气;NH3或NH3H2O;溶浸;
(6)“一次水解”时,产物为Zn(OH)xCly,取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全),则ZnO的物质的量为n(ZnO)=![]() =0.1mol,根据Zn元素守恒,则一次水解产物的物质的量也为0.1mol,则Zn(OH)xCly的摩尔质量为
=0.1mol,根据Zn元素守恒,则一次水解产物的物质的量也为0.1mol,则Zn(OH)xCly的摩尔质量为![]() =106.4g/mol,根据整体呈电中性,则有2=x+y,根据整体摩尔质量为106.4g/mol,则有65+17x+35.5y=106.4,联立x+y=2,65+17x+35.4y=106.4,解得x=1.6、y=0.4,所以一次水解产物的化学式为:Zn(OH)1.6Cl0.4,
=106.4g/mol,根据整体呈电中性,则有2=x+y,根据整体摩尔质量为106.4g/mol,则有65+17x+35.5y=106.4,联立x+y=2,65+17x+35.4y=106.4,解得x=1.6、y=0.4,所以一次水解产物的化学式为:Zn(OH)1.6Cl0.4,
故答案为:Zn(OH)1.6Cl0.4。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案