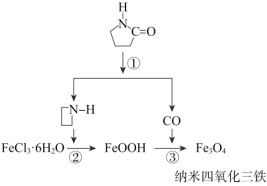
��Ŀ����
����Ŀ�������йص������Һ��˵����ȷ����
A.�����£�0.1 mol/L Na2S��Һ�д��ڣ�c��OH����=c��H+��+c��HS����+c��H2S��
B.0.1mol/L NaHCO3��Һ��0.1mol/L NaOH��Һ�������ϣ�������Һ�У�C(Na��)>c(CO32��)>c(HCO3�� )>c(OH��) >c(H+)
C.pH��ͬ�Ģ�CH3COONa��NaHCO3��NaClO������Һ��c��Na+������>��>��
D.��0.1 mol��L��1�İ�ˮ�м�����������粒��壬����Һ��c��OH����/c��NH3��H2O������
���𰸡�C
��������
A�������£�0.1mol/LNa2S��Һ��������ˮ���Լ��ԣ���Һ�д��������غ㣺c��OH����=c��H+��+c��HS����+2c��H2S������A����
B.0.1mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϵõ�̼������Һ��̼�������ˮ����Һ�Լ��ԣ���Һ������Ũ�ȴ�СΪc��Na+����c��CO32������c��OH������c��HCO3������c��H+������B����
C������ͬ�������²�â�CH3COONa����NaHCO3����NaClO������ҺpH��ͬ����֪���ԣ�CH3COOH��H2CO3��HClO��HCO3��������ˮ��̶ȣ�NaClO��NaHCO3��CH3COONa��pH��ͬʱ����Һ��Ũ�ȣ�NaClO��NaHCO3��CH3COONa����c��Na+���٣��ڣ��ۣ���C��ȷ��
D��0.1molL��1�İ�ˮ�д��ڵ���ƽ�⣺NH3H2O![]() NH4++OH����������������粒������Ƶ���ƽ��������У�����������Ũ�ȼ�С��һˮ�ϰ�Ũ������ֵc��OH����/c��NH3��H2O����С����D����
NH4++OH����������������粒������Ƶ���ƽ��������У�����������Ũ�ȼ�С��һˮ�ϰ�Ũ������ֵc��OH����/c��NH3��H2O����С����D����
��ѡC��

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д� ͬ������ϵ�д�
ͬ������ϵ�д�����Ŀ��ʵ�����Ʊ��屽�ķ�Ӧװ����ͼ��ʾ���ش��������⣺
��֪��
�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
ˮ�е��ܽ�� | �� | �� | �� |
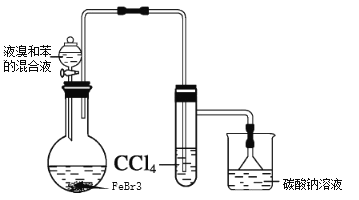
(1)ʵ��װ��c������Ϊ_______��
(2)д��ʵ�����Ʊ��屽�ķ�Ӧ����ʽ_______��
(3)��ʵ��õ����屽��ȥ��м���������²���������a����bˮϴ��c�ø�������d 10%NaOH��Һϴ�ӣ�eˮϴ����ȷ�IJ���˳����________��
(4)��ʵ��ʹ��6mL��ˮ����4.0mLҺ���������м����ַ�Ӧ�������Ƶõ�6.5mL���屽�����ʵ�����屽�IJ�����_______��