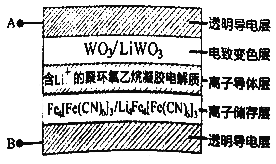
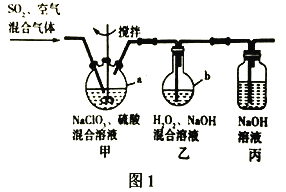
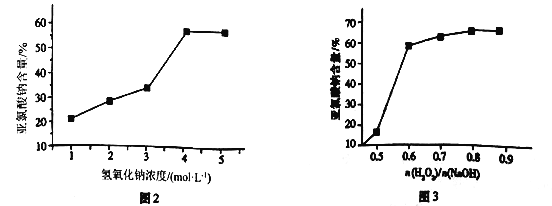
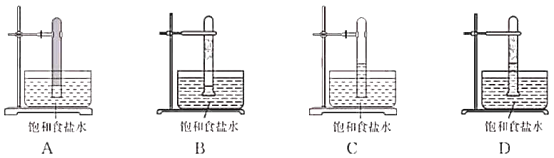
题目内容
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。

(1)能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c过程中的现象是_____,b过程中的化学方程式为_____。
(3)久置的氯水变为____,用化学反应方程式表示为______。
(4)实验室保存饱和氯水的方法是_____。
【答案】d 有白色沉淀生成 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 稀盐酸 2HClO![]() 2HCl+O2↑ 在阴凉处置于棕色试剂瓶中密封保存
2HCl+O2↑ 在阴凉处置于棕色试剂瓶中密封保存
【解析】
将氯气溶于水,部分氯气与水反应生成盐酸和次氯酸,得到浅黄绿色的氯水,氯水含有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的)多种微粒,其性质取决于其组成的微粒。
(1)氯水中HClO具有强氧化性,能使有机色质漂白脱色而表现漂白性,故答案为:d;
(2)氯水中含有Cl-离子,能与AgNO3溶液反应生成白色的氯化银沉淀;氯水中含有酸性强于碳酸的盐酸,能与Na2CO3溶液发生反应生成氯化钠、二氧化碳和水,故答案为:有白色沉淀生成;Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)氯水中HClO不稳定,见光易分解生成盐酸和氧气,溶液的颜色由浅绿色变为无色,反应的化学方程式为2HClO![]() 2HCl+O2↑,故答案为:稀盐酸;2HClO
2HCl+O2↑,故答案为:稀盐酸;2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(4)为防止氯水中HClO见光易分解,应将新制的饱和氯水在阴凉处置于棕色试剂瓶中密封保存,故答案为:在阴凉处置于棕色试剂瓶中密封保存。

 名校课堂系列答案
名校课堂系列答案【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
【题目】为了测定黄铜(铜、锌合金)中铜的质量分数,取20g黄铜样品加入大烧杯中,把200g稀盐酸分四次加入,实验所得数据如下表:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸质量/g | 50 | 50 | 50 | 50 |
剩余固体的质量/g | 16.75 | 13.5 | m | 12.2 |
计算:
(1)表中m=______。
(2)黄铜样品中铜的质量分数为多少?(写出计算过程)______
(3)反应总共产生气体的物质的量是多少?(写出计算过程)_______