题目内容
【题目】亚氯酸钠( NaClO2)是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆漂白、水处理、杀菌灭藻、鱼药制造等行业。工业上可采用过氧化氢法,即在碱性条件下,用H2O2还原ClO2制备 NaClO2。某兴趣小组模拟工业生产流程在实验室中制备NaClO2,实验装置如图1所示。回答下列问题:
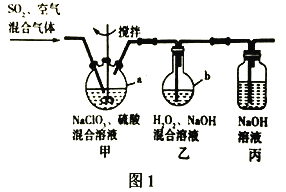
已知:纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
①检査装置气密性;②称取10.65 g NaClO3加入200mL稀硫酸中,溶解,然后转移到仪器a中;③量取适量H2O2加入100 mL NaOH浓溶液中,摇匀后转移到仪器b中;④连接好装置进行实验。
(1)装置甲中空气并不参与反应,则装置甲中发生反应的离子方程式是___________。
(2)进行实验时,需要对装置甲进行水浴加热,水浴加热的优点是________________。
(3)装置丙的作用是_______________________________________________________。
(4)装置乙中制取 NaClO2的离子方程式_________________________________。
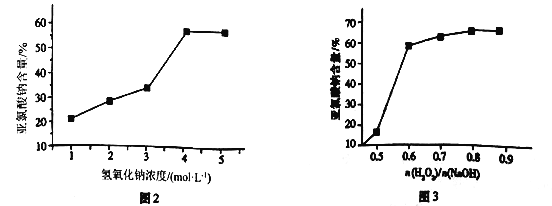
(5)仪器b中的溶质浓度对产品含量起到关键作用,溶质浓度对产品含量的影响如图2和图3所示。结合两图信息,此时混合液中n(H2O2)/n(NaOH)=___________时为最佳,且H2O2的浓度为___________mol·L-1,其可能原因是_________________________________。
(6)实验结束后,在适当的条件下处理b中的混合液,得到产品NaClO2·3H2O 9.39g。该实验的产率为___________。(保留3位有效数字)
【答案】SO2+2ClO3-=2ClO2+SO42- 受热均匀,便于控制温度 吸收ClO2等有害气体,防止污染环境 H2O2+2ClO2+2OH-=2ClO2-+O2+2H2O 0.6 2.4 该反应为放热反应,会造成H2O2分解(或者过量的SO2会还原H2O2),所以n(H2O2)/n(NaOH)稍大于0.5,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳 65.0%
【解析】
(1)装置甲利用NaClO3和Na2SO3在稀硫酸的酸化下,产生ClO2和硫酸钠,据此写出发生反应的离子方程式;
(2)水浴加热的优点是受热均匀,便于控制温度;
(3)ClO2为有害气体,所以装置丙的作用是吸收ClO2等有害气体,防止污染环境;
(4)装置乙中利用ClO2和H2O2在碱性条件下制备NaClO2,据此写出发生反应的离子方程式;
(5)由图3可知,n(H2O2)/n(NaOH) 为0.6时,NaClO2%达到60%,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳;由图2可知,此时c(NaOH)=4mol/L,
则H2O2的浓度为4 mol·L-1×0.6=2.4mol·L-1;
(6)先根据NaClO3~NaClO2·3H2O计算出理论上可制得NaClO2·3H2O的质量,再根据产率=![]() ×100%计算产率。
×100%计算产率。
(1)装置甲利用NaClO3和Na2SO3在稀硫酸的酸化下,产生ClO2和硫酸钠,发生反应的离子方程式是SO2+2ClO3-=2ClO2+SO42-;
因此,本题正确答案为:SO2+2ClO3-=2ClO2+SO42-;
(2)水浴加热的优点是受热均匀,便于控制温度;
因此,本题正确答案为:受热均匀,便于控制温度
(3)ClO2为有害气体,所以装置丙的作用是吸收ClO2等有害气体,防止污染环境;
因此,本题正确答案为:吸收ClO2等有害气体,防止污染环境;
(4)装置乙中利用ClO2和H2O2在碱性条件下制备NaClO2,其中ClO2是氧化剂,H2O2的氧化产物是O2,发生反应的离子方程式为H2O2+2ClO2+2OH-=2ClO2-+O2+2H2O;
因此,本题正确答案为:H2O2+2ClO2+2OH-=2ClO2-+O2+2H2O;
(5)由图3可知,n(H2O2)/n(NaOH) 为0.6时,NaClO2%达到60%,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳,由图2可知,此时c(NaOH)=4mol/L,
则H2O2的浓度为4 mol·L-1×0.6=2.4mol·L-1;
因此,本题正确答案为:0.6;2.4;该反应为放热反应,会造成H2O2分解(或者过量的SO2会还原H2O2),所以n(H2O2)/n(NaOH)稍大于0.5,当超过0.6时,NaClO2%变化不大,考虑经济因素,选择比值为0.6时为最佳;
(6)10.65 g NaClO3的物质的量为![]() =0.1mol,根据NaClO3~NaClO2·3H2O,
=0.1mol,根据NaClO3~NaClO2·3H2O,
理论上可制得NaClO2·3H2O的质量为0.1mol×144.5g/mol=14.45g,
该实验的产率为![]() ×100%=65.0%,
×100%=65.0%,
因此,本题正确答案为:65.0%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


