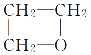题目内容
【题目】已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
【答案】![]() 极性共价键 分子晶体 2NH4Cl + Ca(OH)2
极性共价键 分子晶体 2NH4Cl + Ca(OH)2 ![]() 2NH3↑+ CaCl2 + 2H2O CO32- + H2O
2NH3↑+ CaCl2 + 2H2O CO32- + H2O![]() HCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
HCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
【解析】
X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10,则X为H元素,Y为C元素;L原子的最外层电子数是核外电子总数的3/4,则L为O元素;X、Y、Z原子序数依次增大,则Z为N元素;由于X为H元素,Y为C元素,NY2加水生成Y2X2和化合物甲,Y2X2为C2H2,则NY2为CaC2,化合物甲为Ca(OH)2,N为Ca元素,据此分析解答。
(1)X为H元素,Z为N元素,氢气和氮气反应生成氨气,化合物乙为氨气,则
①氨气为共价化合物,其电子式为![]() ,N原子与H原子间形成极性共价键,氨气的晶体类型为分子晶体;
,N原子与H原子间形成极性共价键,氨气的晶体类型为分子晶体;
②实验室用氢氧化钙固体与氯化铵固体混合加热制取氨气,反应的化学方程式为2NH4Cl + Ca(OH)2![]() 2NH3↑+ CaCl2 + 2H2O;
2NH3↑+ CaCl2 + 2H2O;
(2)Y为C元素,L为O元素,由M、Y、L三种元素组成的物质焰色反应显浅紫色,则M为K元素,则由M、Y、L三种元素组成的物质为K2CO3,由于CO32-水解CO32-+H2O![]() HCO3-+OH-,使溶液显碱性,向其溶液中滴入酚酞溶液,溶液显红色;若再向溶液中滴入过量的氯化钙溶液,由于发生反应Ca2+ + CO32-=CaCO3↓,生成白色沉淀碳酸钙,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去;
HCO3-+OH-,使溶液显碱性,向其溶液中滴入酚酞溶液,溶液显红色;若再向溶液中滴入过量的氯化钙溶液,由于发生反应Ca2+ + CO32-=CaCO3↓,生成白色沉淀碳酸钙,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去;
(3)由以上分析知,Y2X2为C2H2,NY2为CaC2,化合物甲为Ca(OH)2,CaC2与水反应生成C2H2和Ca(OH)2,反应的化学方程式为CaC2 + 2H2O→Ca(OH)2 + C2H2↑。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
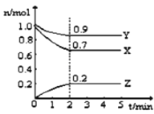
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2 、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________,250s时,H2的转化率为____________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3