��Ŀ����
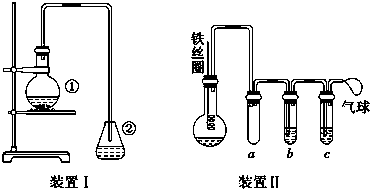
8��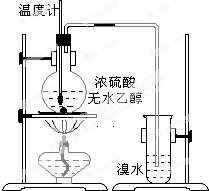 Ϊ̽��ʵ��������ϩ����ϩ����ˮ�ļӳɷ�Ӧ����ͬѧ�������ͼ��ʾ��ʵ��װ�ã���������ʵ�飮���¶�����170������ʱ���д����������������������ͨ����ˮ�У���ˮ����ɫѸ����ȥ����ͬѧ��Ϊ�ﵽ��ʵ��Ŀ�ģ�
Ϊ̽��ʵ��������ϩ����ϩ����ˮ�ļӳɷ�Ӧ����ͬѧ�������ͼ��ʾ��ʵ��װ�ã���������ʵ�飮���¶�����170������ʱ���д����������������������ͨ����ˮ�У���ˮ����ɫѸ����ȥ����ͬѧ��Ϊ�ﵽ��ʵ��Ŀ�ģ���ͬѧ��ϸ�����˼�ͬѧ������ʵ����̣����ֵ��¶�����100������ʱ����ɫҺ�忪ʼ��ɫ����160������ʱ�����Һȫ�ʺ�ɫ����170�泬�������������ٶ����Լӿ죬���ɵ������д̼�����ζ���ɴ����Ƴ���������������Ӧ�����ʣ�����Ӱ����ϩ�ļ���������ȥ���ݴ˻ش��������⣺
��1��д����ͬѧʵ����������Ӧ�Ļ�ѧ����ʽ��CH3CH2OH$��_{170��}^{ŨH_{2}SO_{4}}$CH2=CH2��+H2O��CH2=CH2+Br2��CH2BrCH2Br��
��2����ͬѧ�۲쵽�ĺ�ɫ������C���̼���������SO2����ͬѧ��Ϊ�̼�������Ĵ��ھͲ�����Ϊ��ˮ��ɫ����ϩ�ļӳɷ�Ӧ��ɵģ�
ԭ���ǣ��û�ѧ���̱�ʾ����Br2+SO2+2H2O�T2HBr+H2SO4��
���� ��1��ʵ�����Ʊ���ϩ���õ�ԭ��Ϊ�Ҵ���Ũ��������������ˮ������Ӧ�����Ǽ��ȵ�170�棻��ˮ�е�������ϩ�����ӳɷ�Ӧ��
��2��Ũ�������ǿ��ˮ�ԣ�����������ϩ�������巢����Ӧ���Դ������
��� �⣺��1���Ҵ���Ũ����Ĵ������·�����������ˮ��ȡ��ϩ���Ҵ���������ȥ��ӦΪCH3CH2OH$��_{170��}^{ŨH_{2}SO_{4}}$CH2=CH2��+H2O����ˮ�е�������ϩ�����ӳɷ�Ӧ����CH2=CH2+Br2��CH2BrCH2Br���ʴ�Ϊ��CH3CH2OH$��_{170��}^{ŨH_{2}SO_{4}}$CH2=CH2��+H2O��CH2=CH2+Br2��CH2BrCH2Br��
��2���ɵ��¶�����100������ʱ����ɫҺ�忪ʼ��ɫ����160������ʱ�����Һȫ�ʺ�ɫ����֪Ũ����ʹ�Ҵ���ˮ�����ɺ�ɫ��̼��ͬʱC��Ũ���ᷢ��������ԭ��Ӧ����SO2������Br2+SO2+2H2O�T2HBr+H2SO4����̼�������Ĵ��ڲ�����Ϊ��ˮ��ɫ����ϩ�ļӳɷ�Ӧ��ɵģ��ʴ�Ϊ��C��SO2��Br2+SO2+2H2O�T2HBr+H2SO4��
���� ���⿼������ʵ�飬Ϊ��Ƶ���㣬�������ʵ����ʡ���Ӧԭ��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��������ԭ��Ӧ���ӳɷ�Ӧ�ķ�������Ŀ�ѶȲ���

| ������ | I1 | I2 | I3 | I4 | �� |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | �� |
| A�� | N | B�� | Al | C�� | Si | D�� | Zn |
| A�� | ʯ�͵IJ��� | B�� | ��ϩ�IJ��� | C�� | ���͵IJ��� | D�� | �ϳ���ά�IJ��� |
| A�� | ����������ϡ���ᷴӦ | B�� | п��ϡ���ᷴӦ | ||
| C�� | Ba��OH��2•8H2O��NH4Cl��Ӧ | D�� | ���ȵ�̿�������̼��Ӧ |
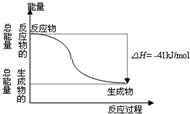 CO��g����H2O��g����Ӧ����CO2��g����H2��g�����̵������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ���ǣ�������
CO��g����H2O��g����Ӧ����CO2��g����H2��g�����̵������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ���ǣ�������| A�� | 1mol CO2��g����1mol H2��g����Ӧ����1molCO��g����1mol H2O��g��Ҫ�ų�41kJ���� | |
| B�� | �÷�ӦΪ���ȷ�Ӧ | |
| C�� | ��Ӧ���Ȼ�ѧ����ʽ�ǣ�CO��g��+H2O ��g��=CO2��g��+H2��g����H=+41kJ/mol | |
| D�� | CO��g����H2O��g���������������CO2��g����H2��g������������� |
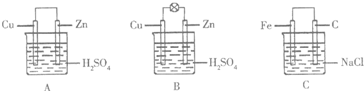
��1����һ�鴿����пƬ����װ��ϡ������ձ���ɹ۲쵽пƬ�������ݣ���ƽ�в���һ��ͭƬ���ɹ۲쵽ͭƬû�У���С���û�С������ݲ��������õ��߰�пƬ��ͭƬ������������ͼA�������һ��ԭ��أ������ĵ缫��ӦʽΪ2H++2e-=H2����
��2������ձ������װ�����2mol/L 500mL��ϡ������Һ������ͭпԭ��أ���ͼB���������������û����ʧ��пʧȥ�ĵ�����ȫ�ص��ߵ�ͭ�缫�������ڱ�״�����ռ���11.2L������ʱ�����ʱ�ձ�����Һ�����ʵ����ʵ���Ũ�ȷֱ�Ϊ����Һ����仯���Բ��ƣ�c��H2SO4��=1mol/L��c��ZnSO4��=1mol/L��
��3������缫���Ϸֱ�����Ƭ��ʯī���������ӣ������Ȼ�����Һ�У���ͼC�������������д�������ĵ缫��ӦʽO2+2H2O+4e-=4OH-��
����ͭ��ĩ��10%H2O2��3.0mol•L-1H2SO4�����Һ����ò�ͬ�¶���ͭ��ƽ���ܽ��������±���
| �¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| ͭ��ƽ���ܽ����� ����10-3mol•L-1•min-1�� | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
 ��
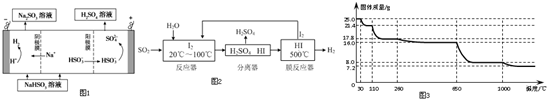
��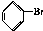 ��Br2��Ҫ��õ������IJ������NaOH��Һ��ˮ�Լ�ϴ�ӣ�
��Br2��Ҫ��õ������IJ������NaOH��Һ��ˮ�Լ�ϴ�ӣ�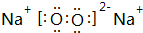 ��
��