题目内容
18. 25℃时,用0.30mol•L-1 NaOH溶液逐滴加入到10mL 0.30mol•L-1某二元酸H2R溶液,测得滴加过程中溶液pH随NaOH溶液体积变化曲线如图所示,下列说法或关系正确的是( )
25℃时,用0.30mol•L-1 NaOH溶液逐滴加入到10mL 0.30mol•L-1某二元酸H2R溶液,测得滴加过程中溶液pH随NaOH溶液体积变化曲线如图所示,下列说法或关系正确的是( )| A. | H2R是弱酸且HR-的电离常数Ka小于它的水解常数Kb | |
| B. | 点②溶液中c(HR-)为点①溶液中c(HR-)的2倍 | |
| C. | 点③所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.10mol•L-1 | |
| D. | 点④所示溶液中:c(HR-)+2c(R2-)+c(OH-)-c(H+)=0.2mol•L-1 |
分析 A、当加入20mLNaOH溶液时,此时两者恰好完全反应,得Na2R溶液,溶液显碱性,可知H2R的酸性强弱;根据当加入10mLNaOH溶液时,所得NaHR溶液显酸性来判断HR-的电离常数Ka和它的水解常数Kb的大小关系;
B、点①是加入5mLNaOH溶液,所得的是0.1mol/LNaHR和0.1mol/LH2R的混合溶液;点②是加入10mLNaOH溶液时,所得的是0.15mol/L的NaHR溶液,据此分析;
C、在③所示的溶液中的溶质为0.06mol/LNa2R和0.06mol/LNaHR的混合溶液,根据物料守恒来分析;
D、点④所示溶液中,加入的20mLNaOH溶液能将10mL 0.30mol•L-1某二元酸H2R溶液恰好完全反应,得0.1mol/L的Na2R溶液,根据电荷守恒来分析.
解答 解:A、当加入20mLNaOH溶液时,此时NaOH和H2R恰好完全反应,得Na2R溶液,溶液显碱性即Na2R为强碱弱酸盐,可知H2R为弱酸;根据当加入10mLNaOH溶液时,此时NaOH和H2R恰好完全反应得NaHR溶液,而HR-即能电离又能水解,而HR-电离显酸性、水解显碱性,根据溶液显酸性可知,HR-的电离大于其水解,即HR-的电离常数Ka大于它的水解常数Kb,故A错误;
B、点①是加入5mLNaOH溶液,所得的是0.1mol/LNaHR和0.1mol/LH2R的混合溶液,由于NaHR的水解和H2R的电离的相互抑制,故溶液中HR-的浓度约为0.1mol/L;点②是加入10mLNaOH溶液时,所得的是0.15mol/L的NaHR溶液,HR-既能水解又能电离,故溶液中HR-的浓度小于0.15mol/L,点②溶液中c(HR-)小于点①溶液中c(HR-)的2倍,故B错误;
C、将15mL的氢氧化钠溶液加入到10mL0.3mol/L的H2R溶液中,得0.06mol/LNa2R和0.06mol/LNaHR的混合溶液,根据物料守恒可知:c(H2R)+c(HR-)+c(R2-)=0.12mol•L-1,故C错误;
D、点④所示溶液中,加入的20mLNaOH溶液能将10mL 0.30mol•L-1某二元酸H2R溶液恰好完全反应,得0.1mol/L的Na2R溶液,
根据电荷守恒有:c(HR-)+2c(R2-)+c(OH-)=c(H+)+c(Na+) ①
而在0.1mol/L的Na2R溶液中,c(Na+)=0.2mol/L ②,
将①②联立即可得:c(HR-)+2c(R2-)+c(OH-)-c(H+)=0.2mol•L-1,故D正确.
故选D.
点评 本题考查了酸碱中和反应过程中的离子浓度的大小比较以及盐溶液的水解和弱酸根的电离,综合性较强,注意三个守恒的运用.

 全程金卷系列答案
全程金卷系列答案| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 | |
| C. | 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C | |
| D. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
| A. | HONO2 | B. | HOCH3 | C. | KOH | D. | CH3COOH |
| A. | 医院里消毒用的来苏水,其主要成分是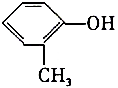 ,它属于酚类 ,它属于酚类 | |
| B. | 护肤用的甘油(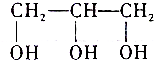 )属于三元醇 )属于三元醇 | |
| C. | 冬天汽车里用的防冻液是乙醇 | |
| D. | 含有-OH(羟基)官能团的有机物不一定是醇类 |
| A. | 30g HCHO与过量的新制的氢氧化铜悬浊液反应转移了4NA个电子 | |
| B. | 1L 1mol/L 醋酸溶液中分子总数小于NA | |
| C. | 在1mol-CHO中所含电子数为15NA | |
| D. | 1mol CaHxNbOc的有机物中,H最多(2a+b+2)NA |
| A. | 纤维素、淀粉、脂肪、蛋白质都是高分子化合物 | |
| B. | 淀粉水解的最终产物都能发生银镜反应 | |
| C. | 误食重金属盐而引起的中毒可服用大量豆浆或牛奶进行解救 | |
| D. | 脂肪能发生皂化反应,生成甘油和高级脂肪酸钠 |