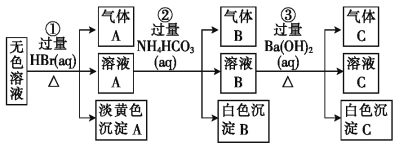
题目内容
【题目】钴镍渣是湿法炼锌净化渣之一,其中含有较多的Zn(II)、Cd(II)和少量Co(II)、Fe(II)、Ni(II)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:
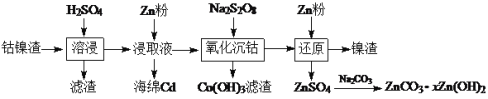
回答下列问题:
(1)“溶浸”时H2SO4的作用是_____________。
(2)向“浸取液”中加入Zn粉后发生反应的离子方程式为__________________。
(3)Na2S2O8中S的化合价为+6,其中过氧键的数目为________。
(4)研究加入Na2S2O8后温度和时间对金属脱除率的影响,所得曲线如下图所示。
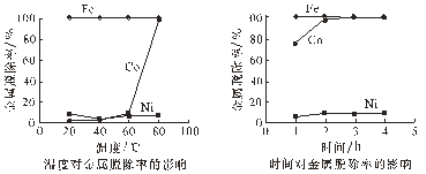
金属脱除是指溶液中的二价金属离子被氧化后形成氢氧化物沉淀而除去。由图可知,Co2+与Ni2+的还原性强弱关系是_________,“氧化沉钴”适宜的条件是________。
(5)在适宜的条件下,加入Na2S2O8并调节溶液pH至5.0~5.2,反应生成Co(OH)3的离子方程式为_______,Co(OH)3滤渣中还含有________。
(6)氧化锌是一种重要而且使用广泛的物理防晒剂,屏蔽紫外线的原理为吸收和散射。由ZnCO3·xZn(OH)2制备氧化锌的方法是__________。
【答案】溶解金属化合物(或使二价金属进入溶液) Zn+Cd2+ =Zn2++Cd 1 Co2+>Ni2+ 80℃,2h 2Co2++S2O82-+6H2O=2Co(OH)3↓+2SO42-+6H+ Fe(OH)3 高温焙烧
【解析】
钴镍渣加入稀硫酸进行酸浸,钴镍渣里面的硫酸盐及氢氧化物溶解在硫酸里,二价金属进入溶液,难溶的杂质经过滤除去,浸取液里加过量的锌粉,利用金属的活泼性不同将Cd置换出来,再加入强氧化剂Na2S2O8将溶液中的二价金属离子氧化为三价然后转化为氢氧化物沉淀除去,最后再加入锌粉经反应后过滤,将滤液中锌离子转化为沉淀ZnCO3·xZn(OH)2。根据以上分析解答。
(1) 钴镍渣加入稀硫酸进行酸浸,钴镍渣里面的硫酸盐及氢氧化物溶解在硫酸里,二价金属进入溶液,难溶的杂质经过滤除去。
答案为:溶解金属化合物(或使二价金属进入溶液)。
(2)向“浸取液”中加入Zn粉,根据题意可知得到了海绵Cd,发生反应的离子方程式为:Zn+Cd2+ =Zn2++Cd。
答案为:Zn+Cd2+ =Zn2++Cd。
(3)Na2S2O8中S的化合价为+6,Na为+1,假设含有x个O2-,含有y个O22-,则有:x+2y=8,(+1)2+(+6)2+(-2)x+(-2)y=0,解得x=6,y=1。
答案为:1。
(4)由题中所给图可知,当Co2+被氧化后形成氢氧化物沉淀而除去时,大量Ni2+还在溶液里,说明还原性Co2+>Ni2+,根据图中信息可知,当溶液中钴完全沉淀时的温度为80℃,所用时间为2h。
答案为:Co2+>Ni2+;80℃,2h 。
(5) 在适宜的条件下,加入Na2S2O8并调节溶液pH至5.0~5.2,Na2S2O8中S为+6价,具有强氧化性,可将Co2+氧化为+3价,生成Co(OH)3沉淀,根据溶液显弱酸性等相关信息,写出反应的离子方程式:2Co2++S2O82-+6H2O=2Co(OH)3↓+2SO42-+6H+,由Na2S2O8强氧化性及图中Co与Fe图象非常靠近的特征可知,此时溶液中的Fe2+也被氧化为+3价形成Fe(OH)3沉淀。
答案为:2Co2++S2O82-+6H2O=2Co(OH)3↓+2SO42-+6H+;Fe(OH)3 。
(6) ZnCO3·xZn(OH)2中的成分有难溶碳酸盐和难溶性碱,根据有关物质的性质可知这些物质受热后分解生成ZnO,工业上可用高温焙烧ZnCO3·xZn(OH)2的方法来制取氧化锌。
答案为:高温焙烧

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案