题目内容
(10分)在密闭容器中,通入xmolH2和ymolI2(g),存在H2+I2(g) 2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
①升高温度,反应速率将 ,平衡将 移动。
②加入催化剂,反应速率将 ,平衡将 移动。
③充入更多的H2,反应速率将 ,平衡将 移动。
④扩大容器的体积,反应速率将 ,平衡将 移动。
⑤容器容积不变,通入氖气,反应速率将 ,平衡将 移动。
 2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)①升高温度,反应速率将 ,平衡将 移动。
②加入催化剂,反应速率将 ,平衡将 移动。
③充入更多的H2,反应速率将 ,平衡将 移动。
④扩大容器的体积,反应速率将 ,平衡将 移动。
⑤容器容积不变,通入氖气,反应速率将 ,平衡将 移动。
增大 左 增大 不 增大 右
减小 不 不 不 (每空1分)
试题分析:当温度升高时,反应速率均增大,由于正反应是放热反应,因此平衡向左移动;加入催化剂后,反应速率增大,但是平衡不移动;当继续充入反应物H2时,反应速率增大,平衡向右移动;扩大容器体积时,实质相当于减小了反应物的浓度,反应速率将减小,由于化学计量数之和前后相等,因此平衡不移动;当容器容积不变,通入氖气,容器内整体压强增大,但是物料的分压不变,同时物料的浓度不改变,因此反应速率不变,平衡也不移动。
点评:在做此类题目时,关键在于首先抓住反应的条件,看清楚是恒压还是恒容,其次看清楚反应物的状态,并判断反应前后是否有气体物质的量的变化。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
 nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH ,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
 pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )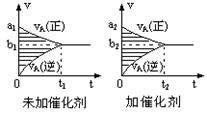

 2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为
2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为  B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示: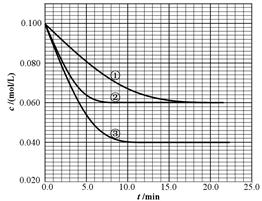
 xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求: CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。