题目内容
(6分)在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)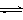 CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
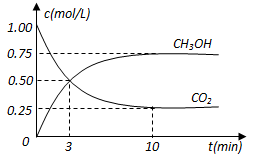
(1)从反应开始到平衡,氢气的平均反应速率v(H2)________________
(2)该反应的平衡常数K为____________________(精确到小数点后两位)
(3)下列能说明反应达到平衡状态的是________________
a.容器中压强保持不变 b.混合气体密度保持不变
c.容器内CO2的分子数保持不变 d.每消耗1 mol CO2的同时生成1 mol H2O
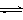 CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)________________
(2)该反应的平衡常数K为____________________(精确到小数点后两位)
(3)下列能说明反应达到平衡状态的是________________
a.容器中压强保持不变 b.混合气体密度保持不变
c.容器内CO2的分子数保持不变 d.每消耗1 mol CO2的同时生成1 mol H2O
(6分)(1)0.225mol/(L·min)(2)5.33 (3)ac(2分)
试题分析:(1)根据图像可知,平衡时,甲醇的浓度变化量是0.75mol/L,所以氢气浓度的变化量就是0.75mol/L×3=2.25mol/L,则氢气的反应速率是2.25mol/L÷10min=0.225mol/(L·min)。
(2)反应前氢气的浓度是3mol/L,所以平衡时氢气的浓度是3mol/L-2.25mol/L=0.75mol/L,则该反应的平衡常数K=
 。
。(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以c正确;该反应是体积减小的,所以在反应过程中,压强也是减小的,因此a正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确;d中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此d中的关系始终是成立,不正确,答案选ac。
点评:判断化学平衡状态的标志有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
 2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
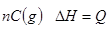 (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示。下列有关叙述中一定正确的是
(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示。下列有关叙述中一定正确的是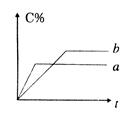
 表示使用了催化剂,
表示使用了催化剂, 没有使用催化剂
没有使用催化剂
 2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 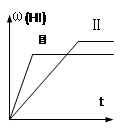
 2B(g) 和2A(g)
2B(g) 和2A(g) CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。
CO2(g) +H2 (g),向2 L密闭容器中通入2 mol CO (g)、1 mol H2O (g),2 min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为________此温度下,该反应的平衡常数为________若往容器中再加入2 mol CO (g),则重新达到平衡时的CO总转化率________20%(填“>”、“<”或“=”)。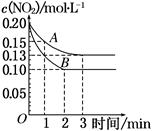
 p C在某温度下达到平衡。
p C在某温度下达到平衡。 H2(g) + CO(g), ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
H2(g) + CO(g), ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1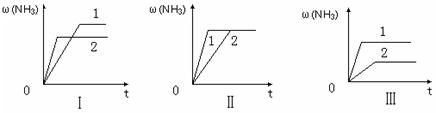
 C(g) △H= - a kJ·mol-1
C(g) △H= - a kJ·mol-1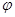 (C) =
(C) = 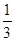 ,则b = ____________。
,则b = ____________。