题目内容
在673K,1.01×105帕下,有1mol某气体A,发生如下反应:2A(气) 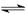 xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数x的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
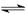 xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
xB(气)+C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数x的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
(1)39.8;(2)32%;(3)2;(4)1.16
【错解分析】(1)达到平衡后混合气的平均摩尔质量为:
0.72g·L-1×22.4L·mol-1=16.128g·mol-1;
平均分子量为:16.1,混合气体的物质的量为2.86mol,由此产生一系列的错误结果。
【正解】本题的错误主要产生于对密度的认识。由于达到平衡时,该体系处于非标准状况下,题目给的密度也是非标准状况下的密度,因此不能简单以该密度和气体的摩尔体积乘积来计算混合气体的平均摩尔质量。
(1)通过以下换算,先计算非标准状况下气体的摩尔体积,进而再计算混合气体的平均摩尔质量:
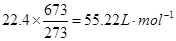 ,
,
所以混合气体平均分子量为:39.8
其余要求可按下式计算:[注:( )表示物质的量,单位为mol]
2A(气)
 xB(气)+C(气)
xB(气)+C(气)(起始) 1 0 0
(变化) 2y xy y
(平衡) 1-2y xy y


(2)A的转化率:

(3)B的系数x=2
(4)在相同状况下,密度比等于其摩尔质量比。所以密度比为:1.16

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( ) 2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不)
2HI(g)正反应为放热反应,改变下列条件,反应速率将如何改变(填增大、减小、或不变),平衡将如何改变(填向左、向右或不) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题: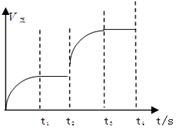
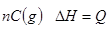 (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示。下列有关叙述中一定正确的是
(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示。下列有关叙述中一定正确的是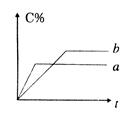
 表示使用了催化剂,
表示使用了催化剂,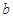 没有使用催化剂
没有使用催化剂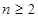
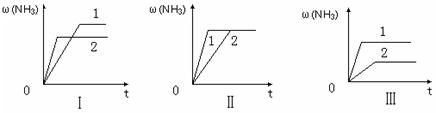
 2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 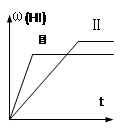
 H2(g) + CO(g), ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
H2(g) + CO(g), ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1