题目内容
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法错误的是( )
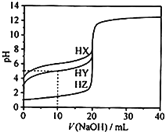
A.HZ是强酸,HX、HY是弱酸
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.向上述HY溶液中滴加任意NaOH溶液时,均存在c(H+)+c(Na+)=c(OH-)+c(Y-)
【答案】C
【解析】
A.0.1000mol·L-1的强酸会完全电离,一元酸则其pH为1,弱酸不完全电离,pH>1,根据图象,HX的pH为1,HY、HZ的pH>1,因此HX为强酸,HY、HZ为弱酸,故A正确;
B.用0.1000mol·L-1的NaOH溶液滴定20.00mL 0.1000mol·L-1的HY溶液,根据图象,当NaOH滴加10mL时,此时溶液中刚好生成NaY和HY物质的量1:1,可认为溶液中c(HY)≈c(Y-),HY的电离平衡常数为Ka(HY)=![]() ≈10-5,故B正确;
≈10-5,故B正确;
C.将上述HX、HY溶液等体积混合后,根据图象分析是HY的酸性强于HX,滴定反应先反应HY,用NaOH溶液滴定至HX恰好完全反应时,此时溶液中为NaX和NaY物质的量1:1关系,由于HY酸性强于HX,则水解程度NaX>NaY,则溶液中c(Y-)>c(X-),水解使溶液呈碱性,则c(OH-)>c(H+),则溶液中离子浓度关系应为:c(Y-)>c(X-)>c(OH-)>c(H+),故C错误;
D. 由电荷守恒,向上述HY溶液中滴加任意NaOH溶液时,均存在c(H+)+c(Na+)=c(OH-)+c(Y-),故D正确;
故选C。

 金钥匙试卷系列答案
金钥匙试卷系列答案