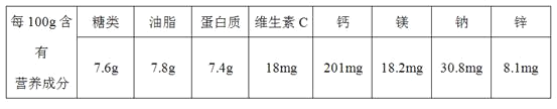
题目内容
【题目】一定条件下,对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.C1:C2=1:3
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2、H2的转化率之比为1:3
D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1
【答案】A
【解析】
A、达平衡时X、Y的浓度分别为0.1mol/L,0.3mol/L,浓度之比是1:3;反应中无论是消耗它们还是生成它们,变化浓度之比肯定也是1:3;末态浓度加消耗掉浓度,所以,起始时也一定是1:3,故A正确;
B、Y的生成速率是υ逆,Z的生成速率是υ正,同一个反应速率用不同的物质表示时,数值与它们的系数成正比,所以H2和NH3的生成速率之比为3:2才表示υ正=υ逆,故B错误;
C、如上A所述,X、Y的起始浓度之比是1:3,消耗浓度之比一定是1:3,所以它们的转化率相等,为1:1,故C错误;
D、如果起始时C3=0,则平衡时Z的浓度0.08mol/L,就是反应生成的,这需要0.04mol/L的X,平衡时X、Y、Z的浓度为0.1mol/L,所以起始时就应该是0.1+0.04=0.14 mol/L,但是题目已知起始时Z的浓度不等于0,C1的取值范围为0mol/L<C1<0.14mol/L,故D正确;
答案选A。

练习册系列答案
相关题目