题目内容
【题目】25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )

A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
【答案】D
【解析】
A、CH3COOH的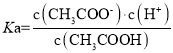 ,取B点状态分析,
,取B点状态分析, =1,且c(H+)=1×10-4.7,所以Ka=1×10-4.7,故A不符合题意;
=1,且c(H+)=1×10-4.7,所以Ka=1×10-4.7,故A不符合题意;
B、C点状态,溶液中含有CH3COONa、NaOH,故c(Na+)>c(CH3COO-),溶液呈碱性,c(OH-)>c(H+),pH=8.85,故此时c(CH3COO-)远大于c(OH-),因此c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B不符合题意;
C、根据电荷平衡,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),B点溶液中,c(CH3COO-)= c(CH3COOH),所以c(Na+)+c(H+)=c(CH3COOH)+c(OH-),故C不符合题意;
D、在溶液中c(CH3COO-)+ c(CH3COOH)=0.1mol/L,A点的溶液中,c(H+)> c(OH-),c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)>0.1mol/L,故D符合题意;
故答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目