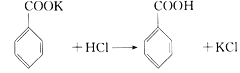
题目内容
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
【答案】C
【解析】
根据电池总反应Zn+2MnO2+H2O=2MnO(OH)+ZnO分析可知,Zn化合价升高,失去电子,故Zn为原电池负极,发生反应为Zn-2e-+2OH-===ZnO+H2O,MnO2的Mn化合价降低,得到电子,作正极,发生的电极反应为:2MnO2+2e-+2H2O=2MnO(OH)+2OH-,结合选项即可分析解答问题。
A.根据上述分析,![]() 电极为电源正极,A选项错误;
电极为电源正极,A选项错误;
B.Zn为原电池负极,发生反应为Zn-2e-+2OH-===ZnO+H2O,则![]() 电极附近溶液的
电极附近溶液的![]() 降低,B选项错误;
降低,B选项错误;
C.MnO2作原电池正极,发生的电极反应为:2MnO2+2e-+2H2O=2MnO(OH)+2OH-,C选项正确;
D.电子只能在外电路中流动,不能流经电解液,D选项错误;
答案选C。

【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1,化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1,化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2,在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请完成下列问题:
(1)通过表格中的数值可以推断:反应①是______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______。
(3)在相同温度下,根据反应①与②可推导出K3与K1、K2之间的关系式____________,据此关系式及上表数据,也能推断出反应③是_____(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ (填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度 D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)已知③的可逆反应CO (g) +H2O(g) ![]() CO2 (g) +H2 (g) ,830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为___________;K的数值为_____________。830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为_______。
CO2 (g) +H2 (g) ,830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为___________;K的数值为_____________。830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为_______。
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。