题目内容
20.A,B,C是三种处在不同短周期元素,原子序数依次减小,三种元素可组成化合物AxByCz,已知(1)x、y、z均为正整数且x+y+z=13;
(2)0.06mol该化合物与过量水反应生成2.4g气体M,同时生成0.05mol的白色沉淀R,R既能溶于盐酸又能溶于氢氧化钠溶液;
(3)同温同压下20mL由B、C组成的气体M完全燃烧时,需要40mLO2,燃烧产物是CO2和H2O.由此可知:三种元素分别是AAlBCCH.气体M的电子式为
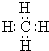 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.
分析 由已知(3)可知M为烃,设其分子式为CaHb;且1 mol烃与2 mol O2恰好反应生成CO2和H2O,即CaHb+2O2→2H2O+CO2,则a=1、b=4,故M为CH4;2.4gCH4的物质的量=$\frac{2.4g}{16g/mol}$=0.15mol,则由已知(2)可知1 mol AxCyHz生成3 mol CH4和1mol R的两性氢氧化物,则x=1,、y=3,由已知(1)1+3+z=13可知:z=9,所以AxByCz化学式为AlC3H9,据此进行解答.
解答 解:根据(3)可知M为烃,设其分子式为CaHb;且1 mol烃与2 mol O2恰好反应生成CO2和H2O,即CaHb+2O2→2H2O+CO2,则a=1、b=4,故M为CH4;2.4gCH4的物质的量=$\frac{2.4g}{16g/mol}$=0.15mol,则由已知(2)可知1 mol AxCyHz生成3 mol CH4和1mol R的两性氢氧化物,则x=1、y=3,由已知(1)1+3+z=13可知:z=9,所以AxByCz化学式为AlC3H9,
根据分析可知,A、B、C分别为Al、C、H;
M为甲烷,甲烷为共价化合物,分子中含有4个碳氢键,甲烷的电子式为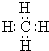 ;AxByCz化学式为:AlC3H9,
;AxByCz化学式为:AlC3H9,
故答案为:Al;C;H;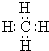 ;AlC3H9.
;AlC3H9.
点评 本题考查无机物的推断,题目难度中等,明确M为烃为解答关键,注意掌握常见元素及其化合物性质,试题有利于提高学生的分析、理解能力及逻辑推理能力.

练习册系列答案
相关题目
10.一定温度下,将 2mol SO2 和 1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,下列说法中正确的是( )
| A. | 达到反应限度时,生成 SO3 为2 mol | |
| B. | 达到反应限度时,反应放出 197 kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率 |
11.下列物质属于离子化合物的是( )
| A. | H2O | B. | HCl | C. | NaCl | D. | CO2 |
15.下列变化规律中正确的是( )
| A. | HF、H2O、CH4、SiH4热稳定性由弱到强 | |
| B. | 微粒按半径从大到小顺序:K>Cl>K+ | |
| C. | C、N、O、F元素的最高正价由低到高 | |
| D. | 相同温度时物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH值由小到大 |
5.利用铝热反应原理焊接钢轨的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,关于该反应的叙述错误的是( )
| A. | 属于置换反应 | B. | A1作还原剂 | ||
| C. | Fe2O3被还原 | D. | 该反应是吸热反应 |
9. 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )| A. | 298K 时,0.1mol•L-1HX 溶液中HX的电离度为1% | |
| B. | V=10mL时,同时微热溶液(忽略体积变化),$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大 | |
| C. | V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) | |
| D. | 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
10.某工业废水中仅含表离子中的5种,且各种离子的物质的量浓度相等.均为0.1mol•L-1.
欲探究废水的组成,进行如下实验:
I.用铂丝蘸取少量溶液液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄淸.且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中听得的溶液中加入BaCl2溶液,有白色沉淀生成.
(1)仅由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+ (写离子符号).
(2)将Ⅲ中所得红棕色气体通人水中,气体变无色,所发生的化学方程式为:3NO2+H2O═2HNO3+NO.
(3)原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
I.用铂丝蘸取少量溶液液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄淸.且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中听得的溶液中加入BaCl2溶液,有白色沉淀生成.
(1)仅由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+ (写离子符号).
(2)将Ⅲ中所得红棕色气体通人水中,气体变无色,所发生的化学方程式为:3NO2+H2O═2HNO3+NO.
(3)原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
 砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:
砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题: