题目内容
5.利用铝热反应原理焊接钢轨的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,关于该反应的叙述错误的是( )| A. | 属于置换反应 | B. | A1作还原剂 | ||
| C. | Fe2O3被还原 | D. | 该反应是吸热反应 |
分析 反应Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3中,Fe元素化合价由+3价降低到0价,被还原,Fe2O3为氧化剂,Al元素化合价由0价升高到+3价,被氧化,Al为还原剂,结合反应的特点解答该题.
解答 解:A.反应符合一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,为置换反应,故A正确;
B.反应中Al元素化合价由0价升高到+3价,被氧化,Al为还原剂,故B正确;
C.Fe2O3中的铁元素化合价由+3价降低到0价,被还原,故C正确;
D.该反应为铝热反应,铝热反应为放热反应,故D错误;
故选D.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意从元素化合价的角度认识相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
15.下列叙述中,正确的是( )
| A. | 氨水显碱性 | B. | 铵盐不易溶于水 | ||
| C. | 氨气可以用浓硫酸进行干燥 | D. | NH3+HCl═NH4Cl属于氧化还原反应 |
10.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如表所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 金属性由强到弱的顺序为:Z、W | |
| B. | 原子半径由大到小的顺序为:Y、Z | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y | |
| D. | 工业上常用电解熔融Z的氧化物得到单质Z |
17.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4$?_{放电}^{充电}$2PbSO4+2H2O下列判断不正确的是( )
| A. | 放电时Pb为负极,此时溶液中的SO42-向Pb电极迁移 | |
| B. | 铅蓄电池电解CuCl2溶液,若制得2.24LCl2(标准状况),这时电池内消耗的H2SO4至少0.2mol | |
| C. | 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极上 | |
| D. | 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
14.分析下图所示的四个原电池装置,其中结论正确的是( )


| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为6H2O+6e-═6OH-+3H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Cl-+2e-=Cl2↑ |
15.提纯下列物质(括号内物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | CCl4 | 萃取、分液 |
| B | 苯(苯酚) | 浓溴水 | 过滤 |
| C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
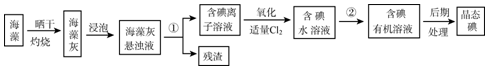
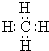 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.