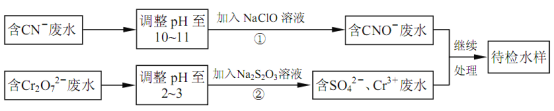
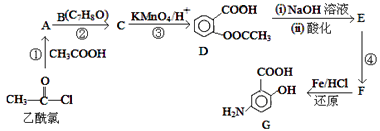
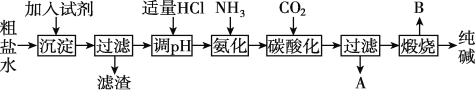
题目内容
【题目】锰及其化合物用途广泛,是生产不锈钢、合金钢、铝锰合金、铜锰合金等的合金元素,高锰酸钾在医疗上用作消毒剂,锰也是人体内多种酶的组成元素。
(1)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性、MnO![]() 具有氧化性,最合适的亚铁盐是________[从“FeSO4”、“FeCl2”和“Fe(NO3)2”中选择填入]。
具有氧化性,最合适的亚铁盐是________[从“FeSO4”、“FeCl2”和“Fe(NO3)2”中选择填入]。
(2)工业上由二氧化锰通过铝热反应制备锰,写出反应的化学方程式:________________________。
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,写出Mn与稀硫酸反应的化学方程式:________________________。
(4)在熔融的Mn和KOH混合物中通入O2可制备K2MnO4。若用MnO2代替Mn也可制得K2MnO4,两种情况下制备相同量的K2MnO4消耗O2的物质的量之比为________。
【答案】FeSO4 4Al+3MnO2![]() 3Mn+2Al2O3 Mn+H2SO4=MnSO4+H2↑ 3∶1
3Mn+2Al2O3 Mn+H2SO4=MnSO4+H2↑ 3∶1
【解析】
(1)MnO![]() 具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。
具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。
(2)工业上,二氧化锰和铝反应,生成锰和氧化铝。
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,因为铝与酸反应,表现+3价,由电子守恒分析,在反应中锰应表现+2价,由此可写出锰与稀硫酸反应的方程式。
(4) 在熔融的Mn和KOH混合物中通入O2可制备K2MnO4,若用MnO2代替Mn也可制得K2MnO4,利用电子守恒,可建立如下关系式:2Mn——3O2——2K2MnO4,2MnO2——O2——2K2MnO4,假设两种情况下制备2molK2MnO4,则消耗O2的物质的量之比。
(1)MnO![]() 具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。所以,最合适的亚铁盐是FeSO4。答案为:FeSO4;
具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。所以,最合适的亚铁盐是FeSO4。答案为:FeSO4;
(2)工业上,二氧化锰和铝反应,生成锰和氧化铝,由二氧化锰通过铝热反应制备锰,反应的化学方程式为4Al+3MnO2![]() 3Mn+2Al2O3。答案为:4Al+3MnO2
3Mn+2Al2O3。答案为:4Al+3MnO2![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,因为铝与酸反应,表现+3价,由电子守恒分析,在反应中锰应表现+2价,由此可写出锰与稀硫酸反应的方程式为Mn+H2SO4=MnSO4+H2↑。答案为:Mn+H2SO4=MnSO4+H2↑;
(4)在熔融的Mn和KOH混合物中通入O2可制备K2MnO4,若用MnO2代替Mn也可制得K2MnO4,利用电子守恒,可建立如下关系式:2Mn——3O2——2K2MnO4,2MnO2——O2——2K2MnO4,假设两种情况下制备2molK2MnO4,则消耗O2的物质的量之比3∶1。
答案为:3∶1。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】物质A~D均含同种元素,都是中学化学中常见的物质,它们之间可发生如图所示的反应(除A~D外的其他物质均已略去)。
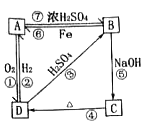
(1)写出相应物质的类别。
物质 | B | C | D |
类别 | ___ | __ | __ |
(2)上述反应①到⑥中,属于离子反应的有___个。
(3)①D→A转化的化学方程式:__。
②B→C转化的离子方程式:__。