题目内容
【题目】下列叙述正确的是
A.分子的中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构
B.1,2-二氯丙烷(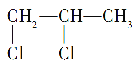 )分子中含有两个手性碳原子
)分子中含有两个手性碳原子
C.熔、沸点:Na<Mg<Al
D.配合物的稳定性与配位键的强弱有关,与配位体的性质无关
【答案】C
【解析】
A.分子的中心原子通过sp3杂化轨道成键时,分子中可能存在孤电子对,比如NH3中N原子为sp3杂化,分子为三角锥型,而甲烷中C原子为sp3杂化,分子为正四面体,故A错误;
B.一个碳原子上连接四种不同的原子或原子团时,该原子为手性碳原子,1,2-二氯丙烷( )分子中只有1个手性碳原子,故B错误;
)分子中只有1个手性碳原子,故B错误;
C.金属的熔沸点由金属键键能大小决定,同周期元素从左到右原子半径依次减小,微粒间结合更牢固,金属键更强:金属键越强,熔点越高,所以熔沸点:Na<Mg<Al,故C正确;
D.配合物的稳定性与配位键的强弱有关,与配位体的性质也有关,故D错误;
答案选C。

练习册系列答案
相关题目
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |