题目内容
17.已知KIO3是食用碘盐的碘添加剂,其制备原理之一为:I2+2KClO3$\frac{\underline{\;873K\;}}{\;}$Cl2+2KIO3,下列说法正确的是( )| A. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| B. | 反应中I2为氧化剂,Cl2为氧化产物 | |
| C. | 生成1 mol Cl2时转移2 mol电子 | |
| D. | 由方程式可知还原性I2>Cl2 |
分析 A.非金属单质的还原性越强,其元素非金属性越弱;
B.反应中得电子的物质为氧化剂;
C.Cl元素从+5价降低到0价;
D.还原剂的还原性大于还原产物的还原性.
解答 解:A.非金属单质的还原性越强,其元素非金属性越弱,还原性:I2>Cl2,则非金属性Cl>I,故A错误;
B.反应中得电子的物质为氧化剂,则KClO3为氧化剂,故B错误;
C.Cl元素从+5价降低到0价,则生成1 mol Cl2有10 mol电子转移,故C错误;
D.还原剂的还原性大于还原产物的还原性,反应中I2为还原剂,Cl2为还原产物,则还原性I2>Cl2,故D正确.
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
7.下列物质不属于硅酸盐的是( )
| A. | 粘土 | B. | 石英 | C. | Al2(Si2O5)OH)4 | D. | Mg2SiO4 |
8.下列哪种化合物不属于天然高分子化合物( )
| A. | 淀粉 | B. | 纤维素 | C. | 氯乙烯 | D. | 蛋白质 |
5.用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是( )
| A. | 苯中的甲苯(溴水、分液) | B. | 溴乙烷中的乙醇(水、分液) | ||
| C. | 乙醇中的水(CaO、蒸馏) | D. | 溴苯中的溴(NaOH溶液、分液) |
9.下列叙述正确的是( )
| A. | 蛋白质水解生成氨基酸 | |
| B. | 糖类、油脂、蛋白质均属于高分子化合物 | |
| C. | 葡萄糖、蔗糖都属于单糖 | |
| D. | 利用油脂在酸性条件下水解制取肥皂 |
2.(1)为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内.
(2)a.在洁净的试管中加入少量硝酸银溶液,再逐滴滴加稀氨水,现象是先生成白色沉淀,反应的离子方程式是①Ag++NH3•H2O=AgOH↓+NH4+;继续滴加至沉淀恰好溶解,即得银氨溶液,反应的离子方程式为②AgOH+2NH3=[Ag(NH3)2]++OH-;
b.向a中所得的银氨溶液中滴入少量葡萄糖溶液,混合均匀后,放在水浴中加热3min~5min,即可在试管内壁上形成银镜,则此反应的化学方程式为(葡萄糖的结构简式用G-CHO表示):③G-CHO+2Ag(NH3)2OH$\stackrel{△}{→}$G-COONH4+2Ag↓+3NH3+H2O.
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.盐析、过滤 d.萃取 | ① | ||
| ②乙醇(水) | ② | ||||
| ③肥皂(甘油、水) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
b.向a中所得的银氨溶液中滴入少量葡萄糖溶液,混合均匀后,放在水浴中加热3min~5min,即可在试管内壁上形成银镜,则此反应的化学方程式为(葡萄糖的结构简式用G-CHO表示):③G-CHO+2Ag(NH3)2OH$\stackrel{△}{→}$G-COONH4+2Ag↓+3NH3+H2O.
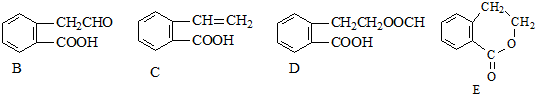
 ,它可通过不同化学反应分别制得如图B、C、D和E四种物质.
,它可通过不同化学反应分别制得如图B、C、D和E四种物质. ,反应类型:氧化反应
,反应类型:氧化反应 +H2O,反应类型:酯化反应或取代反应
+H2O,反应类型:酯化反应或取代反应 .
.

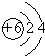 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0; →
→ .
.