题目内容
16.有关电化学知识的描述正确的是( )| A. | 理论上来说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| B. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 | |
| C. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极,其负极反应式为Fe-2e-═Fe2+ | |
| D. | 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-═Mg(OH)2 |
分析 A.构成原电池内界条件是自发的发生氧化还原反应;
B.盐桥中的物质一般是强电解质,且不和电解质溶液中的电解质反应;
C.Fe遇到浓硝酸会钝化;
D.原电池中失电子的一极为负极.
解答 解:A.构成原电池内界条件是自发的发生氧化还原反应,所以理论上说,任何能自发进行的氧化还原反应都可设计成原电池,故A正确;
B.在原电池的正极端氯离子和银离反应,所以不可以用KCl饱和溶液制得的琼脂,故B错误;
C.Fe遇到浓硝酸会钝化,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是Cu作负极,Fe作正极,其负极反应式为Cu-2e-═Cu2+,故C错误;
D.原电池中失电子的一极为负极,由Al、Mg与氢氧化钠溶液组成的原电池中,Al在负极失电子生成偏铝酸根离子,Mg作正极,故D错误.
故选A.
点评 本题考查了原电池原理,知道原电池反应特点、正负极的判断方法即可解答,易错选项是C、D,注意:不能根据金属的活泼性强弱判断正负极,要根据失电子判断正负极,为易错点.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | 某物质灼烧时,焰色反应为黄色;则该物质中一定含钠元素,不含钾元素 | |
| B. | 新制的氯水保存在棕色玻璃试剂瓶中 | |
| C. | 氯气有毒,所以氯离子也有有毒 | |
| D. | 漂白粉相对氯水较稳定,所以可以露置在空气中保存 |
4.下列物质间的反应属于消去反应的是( )
| A. | 乙烯气体通入溴的四氯化碳溶液 | |
| B. | 加热浓硝酸和苯(浓硫酸作催化剂)制取硝基苯 | |
| C. | 加热溴乙烷和氢氧化钾的水溶液 | |
| D. | 加热溴乙烷和氢氧化钾的醇溶液 |
8.荧火黄既可用作颜料,也用作指示剂,其合成路线如下图:
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 1 mol荧火黄完全燃烧消耗标准状况下氧气体积为459.2L | |
| B. | 荧火黄分子中含有两种含氧官能团 | |
| C. | 1 mol荧火黄最多可与含4 mol NaOH的溶液完全反应 | |
| D. | 荧火黄的分子式为C20H14O5 |
17.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能.也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.请填写下列空白:
(1)二甲醚的核磁共振H谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚、空气、氢氧化钾溶液、多孔石墨电极可构成燃料电池.该电池中负极的电极反应式是:CH3OCH3+16OH--12e-═2CO32-+11H2O,则正极的电极反应式是6H2O+3O2+12e-=12OH-.
(3)已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为225.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v(正)> v(逆)(填“>”、“<”或“=”),因为该时刻的浓度商QC<平衡常数225(填“>”、“<”或“=”).
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH转化率α (CH3OH) (计算结果用百分数表示,保留小数后一位).
(1)二甲醚的核磁共振H谱图中有1个吸收峰,官能团名称是醚键.
(2)二甲醚、空气、氢氧化钾溶液、多孔石墨电极可构成燃料电池.该电池中负极的电极反应式是:CH3OCH3+16OH--12e-═2CO32-+11H2O,则正极的电极反应式是6H2O+3O2+12e-=12OH-.
(3)已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为225.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.60 | 0.60 |
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH转化率α (CH3OH) (计算结果用百分数表示,保留小数后一位).
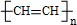 、
、 .
.