题目内容
16.明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4、和H2SO4的过程如下所示:
请回答下列问题:
(1)Al的原子结构示意图为
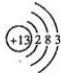
(2)从水浸后的滤液中得到K2SO4晶体的方法是蒸发结晶.
(3)Al2O3在一定条件下可制得KAlO2,其反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(4)配平焙烧明矾的化学方程式为:
4KAl(SO4)2•12H2O+3 S═2K2SO4+2Al2O3+9SO2+48H2O
若生成标况下11.2L的SO2,则转移的电子的物质的量为0.67mol
(5)焙烧产生的SO2可用于制硫酸,焙烧948t明矾(M=474g/mol),若SO2的转化率为96%,可产生质量分数为98%的硫酸432t.
分析 (1)铝为13号元素,核外有13个电子,根据核外电子排布规律可画出原子结构示意图;
(2)水浸后的滤液中的溶质为K2SO4,从硫酸钾溶液中获得到K2SO4晶体,可以用蒸发结晶的方法;
(3)Al2O3与氢氧化钾反应可制得KAlO2,根据电荷守恒和元素守恒可书写离子方程式;
(4)在该反应中硫酸根中的部分硫元素从+6价降为+4价,硫单质中硫从0价升为+4价,根据化合价升降法结合元素守恒可配平该氧化还原反应,根据氧化还原反应中二氧化硫与电子转移数目的关系计算转移电子的物质的量;
(5)根据焙烧方程式可知焙烧948t明矾产生二氧化硫的质量,再利用硫元素守恒计算出硫酸的质量.
解答 解:(1)铝为13号元素,核外有13个电子,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)水浸后的滤液中的溶质为K2SO4,从硫酸钾溶液中获得到K2SO4晶体,可以用蒸发结晶的方法,故答案为:蒸发结晶;
(3)Al2O3与氢氧化钾反应可制得KAlO2,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)在该反应中硫酸根中的部分硫元素从+6价降为+4价,硫单质中硫从0价升为+4价,根据化合价升降法结合元素守恒可知,该氧化还原反应为4kAl(SO4)2﹒12H2O+3S=2k2SO4+2Al2O3+9SO2+48H2O,根据反应可知,每生成9mol二氧化硫,反应中转移电子12mol,所以标况下11.2L即0.5mol的SO2,则转移的电子的物质的量为0.67mol,
故答案为:4、3、2、2、9、48; 0.67mol;
(5)设可产生质量分数为98%的硫酸为xt,
根据焙烧方程式有关系式4kAl(SO4)2﹒12H2O~9H2SO4
4×474 9×98
948t×96% xt×98%
$\frac{4×474}{948t×96%}$=$\frac{9×98}{xt×98%}$,解得:x=432,
故答案为:432.
点评 本题考查了氧化还原反应的分析,氧化还原反应的配平,化学计算等,题目难度中等,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及化学计算能力.

| A. | [H+][OH-]乘积不变 | B. | pH增大了 | ||
| C. | [H+]降低了 | D. | 水电离出的[H+]增加了 |
| A. | 理论上来说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| B. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 | |
| C. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极,其负极反应式为Fe-2e-═Fe2+ | |
| D. | 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-═Mg(OH)2 |
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是放暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加 B.重新配料 C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(6)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据如表;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是b.
a.圆底烧瓶 b. 容量瓶 c.锥形瓶 d.量筒
(2)溴代烃的水溶性小于(填“大于”、“等于”或“小于”)相应的醇;其原因是醇分子可与水分子之间形成氢键,溴代烃不能与水分子之间形成氢键.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是a.
a. 水是反应的催化剂 b.减少Br2的生成 c.减少HBr的挥发 d.减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是平衡向生成溴乙烷的方向移动(或反应②向右移动);但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出.