题目内容
【题目】铁元素、氮元素有多种可变价态,在氧化还原反应中常以不同价态出现,根据题中信息,完成下列填空:
(1)金属与硝酸反应通常还会生成NO和NO2,当n(NO): n(NO2)<1时,产生的气体可以完全被氢氧化钠溶液吸收,写出除去这两种气体的方法,以化学方程式表示_________、_______
(2)室温下,0.1mol/L的亚硝酸、次氯酸钠的电离常数HNO2:Ki =7.1× 10-4, HClO: Ki =2.98× 10-8,将0.1mol/L的亚硝酸稀释100倍,c(H+)=将(填“不变”、“增大”、“减小”)_______;Ki值将(填“不变”、“增大”、“减小”)_______。写出HNO2、HClO、NaNO2、NaClO四种物质,可能相互之间发生的离子互换反应的离子方程式_________。
(3)亚硝酸钠与氯酸钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生红棕色刺激性气味气体,该气体为______;实验室鉴别氯化钠和亚硝酸钠的方法之一是测定等浓度NaNO2、NaClO的pH,其鉴别的理由是______________。
(4)现有11.2g铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为________,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,铁与稀硝酸的反应产物中一定含有的金属阳离子是______,若反应后的溶液最多可溶解铜粉6.4g,写出上述过程中铁与稀硝酸反应的化学方程式___________。
【答案】2NaOH+ NO2+ NO = 2NaNO2 +H2O 2NaOH+NO2 = NaNO2 + NaNO3 + H2O 减小 不变 HNO2+ClO2-=NO2- + HClO NO2 亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,为中性,所以他们同浓度的盐溶液的pH不同 N2 Fe3+ 10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O
【解析】
(1) NO、NO2按1: 1混合时,与三氧化二氮,与氢氧化钠反应生成亚硝酸钠,由于n(NO):n(NO2)<1,上述反应剩余二 氧化氮,二氧化氮与氢氧化钠反应生成硝酸钠、亚硝酸钠与水;
(2)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关;
(3)红棕色刺激性气味气体为NO2;亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,溶液为中性;
(4)铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为N2,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,则溶液中含有Fe3+ ,根据电子转移守恒,书写反应方程式。
(1)NO、NO2按1:1混合时,与三氧化二氮,与氢氧化钠反应生成亚硝酸钠,由于n(NO): n(NO2) < 1,上述反应剩余二氧化氮,二氧化氮与氢氧化钠反应生成硝酸钠、亚硝酸钠与水,相应化学方程式为: 2NaOH+ NO2+ NO = 2NaNO2 +H2O;2NaOH+NO2 = NaNO2 + NaNO3 + H2O,故答案为:2NaOH+ NO2+ NO = 2NaNO2 +H2O (2). 2NaOH+NO2 = NaNO2 + NaNO3 + H2O;
(2)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关,与浓度无关,K值不发生变化;由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,可能相互之间发生的离子互换,反应的离子方程式为:HNO2+ClO2-=NO2- + HClO,故答案为:减小;不变;HNO2+ClO2-=NO2- + HClO;
(3)红棕色刺激性气味气体为NO2;亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,溶液为中性,所以他们同浓度的盐溶液的pH不同,故答案为:NO2;亚硝酸是弱酸,亚硝酸钠水解显碱性,氯化钠不水解,为中性,所以他们同浓度的盐溶液的pH不同;
(4)铁单质恰好与稀硝酸反应,生成无污染的单质气体,该单质气体为N2,在反应后的溶液中加入铜粉,铜粉可以继续溶解,且无气体生成,则溶液中含有Fe3+,6.4gCu为0.1mol,根据电子转移守恒,溶液中n(Fe3+)=![]() = 0.2mol,而n(Fe)=
= 0.2mol,而n(Fe)=![]() ,由Fe元素守恒可知反应生成Fe(NO3)3,该反应方程式为:10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O,故答案为:N2; Fe3+ ;10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O。
,由Fe元素守恒可知反应生成Fe(NO3)3,该反应方程式为:10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O,故答案为:N2; Fe3+ ;10Fe+36HNO3 =10Fe(NO3)3+3N2↑+18H2O。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示:
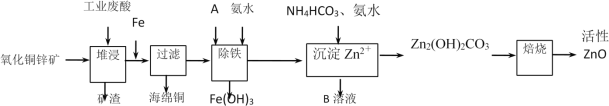
已知:各离子开始沉淀及完全沉淀时的pH如表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)加入A物质的目的是___,物质A可使用下列物质中的___。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)___Ksp(ZnS)(选填“>”“<”或“=”)。
(3)反应生成海绵铜的离子方程式:___。
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在___范围之间。
(5)写出NH4HCO3溶液与Zn2+反应生成Zn2(OH)2CO3的离子方程式:___。
(6)物质B可用作生产化肥,其化学式是___。
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
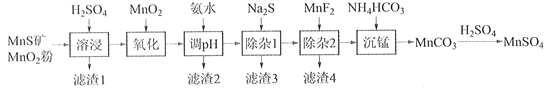
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
