题目内容
【题目】X、Y、Z 是中学化学常见的三种物质,它们之间的相互转化关系如下(X、Y、Z、E、F 为英文字母,部分反应条件及产物略去)

I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
(1)Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,化学方程式为_____。
(2)Z的水溶液可以制得某种强酸 E。实验室用 98%的浓 E(ρ = 1.84g·cm3)溶液配制l.5mol·L1稀 E 溶液240mL。
① 制该稀 E 溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒 和_____ ;
II.若Z是淡黄色固体粉末。
在呼吸面具或潜水艇中由Z和 CO2制备氧气的化学反应方程式为_____。
III.若Z是红棕色气体。
(1)试写出 Z 与水反应制备另一种强酸 F 的化学方程式_____。
(2)2.0g铜镁合金完全溶解于100mL 密度为 1.40g·mL1质量分数为 63%的浓F溶液中,得到Z 和N2O4(Z和N2O4均为浓F 溶液的还原产物)的混合气体1792mL(标准状况),向反应后的溶液中加入1.0mol·L1NaOH 溶液,当金属离子全部沉淀,得到3.7g沉淀。则合金中铜与镁的物质的量之比为_____,加入 NaOH 溶液的体积为_____ mL 。
【答案】2NH3H2O+SO2=(NH4)2SO3+H2O 250mL容量瓶 2Na2O2+2CO2=2Na2CO3+O2 3NO2+H2O=2HNO3+NO 2:3 1300
【解析】
I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体,则Y为SO2;
II.若Z是淡黄色固体粉末,则Z为Na2O2;
III.若Z是红棕色气体,则Z为NO2,X为N2或NH3,Y为NO。
I.(1)根据分析,Y为SO2,SO2的大量排放会形成酸雨,在工业上可以用足量氨水吸收,生成亚硫酸铵和水,其反应的化学方程式为:2NH3H2O+SO2=(NH4)2SO3+H2O,故答案为:2NH3H2O+SO2=(NH4)2SO3+H2O。
(2)①二氧化硫氧化生成三氧化硫,三氧化硫溶于水得硫酸,E是硫酸。实验室用98%浓硫酸(ρ=1.84mgcm3)溶液配制1.5molL1稀硫酸溶液240mL,依据配制溶液的步骤可知,需用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒、250mL容量瓶,故答案为:250mL容量瓶。
II. 根据分析,Z为Na2O2,在呼吸面具或潜水艇中Na2O2和CO2制备O2的化学反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。
III.(1) Z为NO2,X为N2或NH3,Y为NO,NO2与H2O反应生成HNO3和NO,其化学反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO。
(2)F为HNO3,金属离子全部沉淀时,得到3.7g沉淀为氢氧化铜和氢氧化镁,所以沉淀中氢氧根离子的质量为3.7g2g=1.7g,氢氧根离子的物质的量为: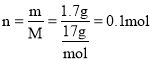 ,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:![]() ,计算得出:
,计算得出:![]() ,所以合金中铜与镁的物质的量之比是0.02:0.03=2:3;标准状况下,NO2和N2O4混合气体的物质的量为:
,所以合金中铜与镁的物质的量之比是0.02:0.03=2:3;标准状况下,NO2和N2O4混合气体的物质的量为:![]() ,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.08a)mol,根据电子转移守恒可知,a×1+(0.08a)×2×1=0.1,计算得出:a=0.06mol,则N2O4的物质的量为0.02mol,根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为:
,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.08a)mol,根据电子转移守恒可知,a×1+(0.08a)×2×1=0.1,计算得出:a=0.06mol,则N2O4的物质的量为0.02mol,根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为:![]() 0.06mol0.02mol×2=1.3mol,所以需要氢氧化钠溶液的体积为:
0.06mol0.02mol×2=1.3mol,所以需要氢氧化钠溶液的体积为: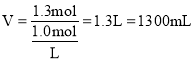 ,故答案为:2:3;1300。
,故答案为:2:3;1300。

【题目】下列指定反应的化学用语表达正确的是( )
A | 质子交换膜氢氧燃料电池的负极反应 | O2+2H2O+4e﹣=4OH﹣ |
B | 用铁电极电解饱和食盐水 | 2Cl﹣+2H2O=Cl2↑+H2↑+20H﹣ |
C | 锅炉水垢中的CaSO4用饱和Na3CO3溶液浸泡 | CO32﹣+CaSO4=CaCO3+SO42﹣ |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO43﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
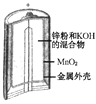
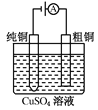
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,正极质量不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D. 图Ⅳ所示电池中,放电时,负极附近溶液的pH不变