题目内容
【题目】如图为周期表的一部分,表中所列的字母分别代表一种化学元素。回答下列问题:
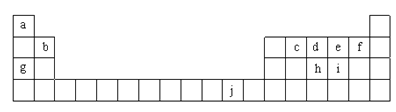
(1)f的基态原子核外电子排布式______。
(2)在c2a4分子中,c为______杂化,c与c间存在的共价键类型有______两种。
(3)ci2与ce2比较,沸点较高的是______(写分子式),其原因是_________________。
(4)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液是由于存在______(写结构式),其中配体是_____。
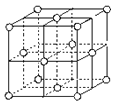
(5)j的金属晶体的晶胞如图所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是______个,已知该元素的相对原子质量为64,单质晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,试求铜的金属半径为__________ pm(用含NA、ρ的表达式表达)。
【答案】1s22s22p5 sp2 δ和π CS2 CS2相对分子质量较大  NH3 12
NH3 12 ![]()
【解析】
(1)由表可以看出f为F;
(2)由表可以看出C为C,a为H,则c2a4为C2H4;
(3)由表可以看出,C为C,i为S,e为O,所以ci2与ce2分别为:CS2与CO2;
(4)j为Cu,所以将氨水滴加到CuSO4溶液中,发生反应生成蓝色Cu(OH)2沉淀;当氨水过量时,蓝色沉淀转化成深蓝色溶液;
(5)依据表可知j为铜,由铜的晶胞可以看出,一个晶胞中每个Cu原子周围与它最接近且距离相等的Cu为面心上的铜原子, 利用均摊法计算一个晶胞中铜原子个数,设铜原子半径为r,利用密度公式计算r即可。
(1)由表可以看出f为F,则9号元素F的基态原子核外电子排布式为:1s22s22p5;
本题答案为:1s22s22p5。
(2)因为C是C,a是H,则c2a4为C2H4,在乙烯的分子中C为sp2杂化,碳碳之间是双键,其中有一个δ键、一个π键;
本题答案为:sp2 ,δ和π。
(3)由分析知:ci2与ce2分别为:CS2与CO2,由于CS2的相对分子质量比CO2大,所以分子间作用力CS2![]() CO2,沸点CS2
CO2,沸点CS2![]() CO2;
CO2;
本题答案为:CS2 ,CS2相对分子质量较大。
(4)j为Cu,所以将氨水滴加到CuSO4溶液中,发生反应生成蓝色Cu(OH)2沉淀,当氨水过量时,Cu(OH)2蓝色沉淀转化成Cu(NH3)4SO4深蓝色溶液;
本题答案为: ,NH3。
,NH3。
(5)由分析知道,j为铜,由铜的晶胞可以看出,一个晶胞中每个Cu原子周围与它最接近且距离相等的Cu为面心上的铜原子,共有3![]() 8
8![]() 2=12个,
2=12个,
根据均摊法,一个晶胞含有Cu原子个数为8![]() +6
+6![]() =4,根据
=4,根据![]() =
=![]() ,晶胞体积V=
,晶胞体积V=![]() =
=![]() cm3,设晶胞棱长为x,则x=
cm3,设晶胞棱长为x,则x=![]() =
=![]() cm,设Cu原子半径为r,则x2+ x2=(4r)2,解得r=
cm,设Cu原子半径为r,则x2+ x2=(4r)2,解得r=![]() x=
x=![]() cm=
cm=![]() pm;
pm;
本题答案: 12 , ![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②