题目内容
一元弱酸HA(aq)中存在下列电离平衡:HA  H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )。
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )。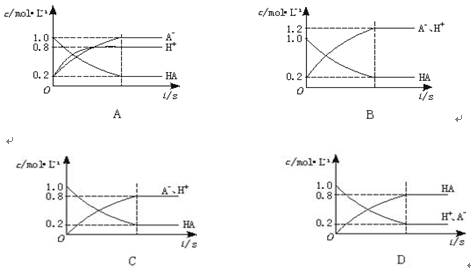
 H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )。
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )。
C
由HA  H++A-,可知,HA浓度减小,H+与A-以等物质的量浓度增多,排除AD;如果HA浓度减小到0.2mol/L,则生成H+、A-均为0.8mol/L,答案为C
H++A-,可知,HA浓度减小,H+与A-以等物质的量浓度增多,排除AD;如果HA浓度减小到0.2mol/L,则生成H+、A-均为0.8mol/L,答案为C
 H++A-,可知,HA浓度减小,H+与A-以等物质的量浓度增多,排除AD;如果HA浓度减小到0.2mol/L,则生成H+、A-均为0.8mol/L,答案为C
H++A-,可知,HA浓度减小,H+与A-以等物质的量浓度增多,排除AD;如果HA浓度减小到0.2mol/L,则生成H+、A-均为0.8mol/L,答案为C
练习册系列答案
相关题目
 HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol 。回答下列问题:
。回答下列问题:
 ,则
,则 )= 。
)= 。 )+c(MOH) 2c(A
)+c(MOH) 2c(A
 -3 mol·L-1的Ba(OH)2溶液d L。其中a、b、c、d的关系正确的是
-3 mol·L-1的Ba(OH)2溶液d L。其中a、b、c、d的关系正确的是