题目内容
下列说法正确的是
| A.常温下,某溶液中由水电离的C(OH-)=10-3 mol/L,则该溶液可能为NH4Cl或NaOH溶液 |
| B.常温时浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离的C(OH-)前者大于后者 |
| C.1 mL PH=1的H2SO4与100 mLNaOH溶液混合后PH=7,则原NaOH溶液PH=11 |
| D.25℃时PH=5的CH3COOH溶液和100℃时PH=5的AlCl3溶液C(H+)相等 |
D
A 错误,由水电离的C(OH-)=10-3 mol/L大于10-7 mol/L,所以,是促进水的电离,有弱离子的盐能促进水的电离,碱会抑制水的电离。不会是NaOH溶液
B 错误,KHCO3水解程度小于K2CO3,溶液中水的电离程度KHCO3溶液小于K2CO3,由水电离的C(OH-)前者小于后者
C 错误,题中没有表明温度
D 正确,PH相同,溶液中H+浓度相同。
B 错误,KHCO3水解程度小于K2CO3,溶液中水的电离程度KHCO3溶液小于K2CO3,由水电离的C(OH-)前者小于后者
C 错误,题中没有表明温度
D 正确,PH相同,溶液中H+浓度相同。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )。
H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )。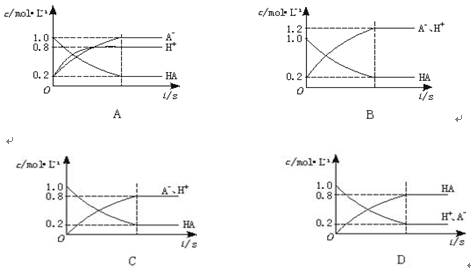
 α3
α3 溶液与ymL pH=b的稀盐酸充分反应。下列前于反应溶液pH的判断,正确的是
溶液与ymL pH=b的稀盐酸充分反应。下列前于反应溶液pH的判断,正确的是