题目内容
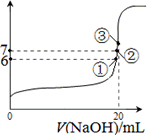
25℃时,在20 mL 0.1 mol·L-1盐酸中逐滴加入0.2 mol·L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是
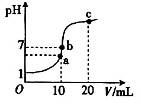
A.在b点,盐酸与氨水恰好完全中和
B.在b点:c(H+)=c(OH-),c(NH4+)=c(Cl-)
C.在a点:c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.在c点:c(NH4+)+ c(NH3·H2O)=2 c(Cl-)
C
【解析】
试题分析: A、在b点,氨水量多于盐酸,不能恰好完全中和,错误;B、呈中性,则溶液中必有c(H+)=c(OH-),根据电荷守恒c(NH4+)=c(Cl-),正确;C、在a点,氨水量等于盐酸,恰好完全中和生成氯化铵溶液,NH4+会部分水解,c(Cl-)> c(NH4+)> c(H+)> c(OH-),正确;D、形成等浓度的氨水和氯化铵的混合溶液,根据物料守恒:c(NH4+)+ c(NH3·H2O)=2 c(Cl-),正确。
考点:考查弱电解质,电解质溶液离子浓度、沉淀溶解平衡的综合应用等相关知识。

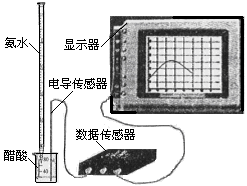
右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。
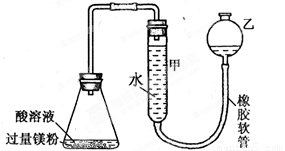
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
|
酸溶液 |
酸溶液 |
气体体积/mL |
反应时间 |
|
|
(实验A) |
(实验B) |
(25℃、101 kPa) |
实验A |
实验B |
|
CH3COOH 0.1 mol/L 40.00mL |
HCl溶液 0.1 mol/L 40.00mL |
5 |
t(a1)=155 s |
t(b1)=7 s |
|
10 |
t(a2)=310 s |
t(b2)=16 s |
||
|
15 |
t(a3)=465 s |
t(b3)=30 s |
||
|
20 |
t(a4)=665 s |
t(b4)=54 s |
||
|
…… |
…… |
…… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
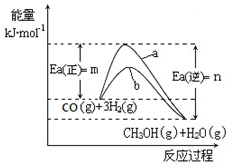
 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
 ①温度升高,K值
①温度升高,K值