题目内容
把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态.分析表中的实验数据后回答有关问题((2)(3)小题用A、B、C、D填空).
(1)①②③分别为
(2)都达到平衡时,
(3)四个容器的容积由小到大的顺序是
| 容器代码 | A | B | C | D | ||
平衡时
|
16 | 17 | ||||
| 平衡时N2转化率 | 20% | ① | ② | ③ | ||
| 平衡时H2转化率 | 30% |
10%
10%
、6.25%
6.25%
、11.8%
11.8%
.(2)都达到平衡时,
A
A
容器的NH3的物质的量所占的比例最大.(3)四个容器的容积由小到大的顺序是
A<D<B<C
A<D<B<C
.分析:(1)因合成氨反应是气体分子总数缩小的反应,故容器的容积越小的,该体系内压强越大,反应向正反应方向进行的程度大,故α(N2)和α(H2)越大,平衡混合气体NH3的含量越大,则平均相对分子质量越大,令四个容器内的N2和H2均为1 mol,设氮气的转化率为x,利用三段式表示平衡时B、C、D容器内各组分的物质的量,进而计算转化率;
(2)氮气的转化率越大,容器中NH3所占的比例最大;
(3)反应开始时,四容器中n(N2)和n(H2)相同,反应温度也相同,但转化率不同,体积越小,压强越大,反应物转化率高,平衡时平均相对分子质量越大.
(2)氮气的转化率越大,容器中NH3所占的比例最大;
(3)反应开始时,四容器中n(N2)和n(H2)相同,反应温度也相同,但转化率不同,体积越小,压强越大,反应物转化率高,平衡时平均相对分子质量越大.
解答:解:(1)令平衡时N2转化率为x,则:
N2+3H2?2NH3
起始(mol):1 1 0
变化(mol):x 3x 2x
平衡(mol):1-x 1-3x 2x
对于B容器,则
=30%,解得x=10%
对于C容器,则
=16,解得x=6.25%
对于D容器,则
=17,解得x=11.8%
故答案为:10%;6.25%;11.8%;
(2)由上述分析可知,α(N2)和α(H2)越大,平衡混合气体NH3的含量越大,氮气转化率A>D>B>C,故A容器的NH3的物质的量所占的比例最大,
故答案为:A;
(3)体积越小,压强越大,反应物转化率高,由上述分析可知,氮气转化率A>D>B>C,故体积A<D<B<C,
故答案为:A<D<B<C.
N2+3H2?2NH3
起始(mol):1 1 0
变化(mol):x 3x 2x
平衡(mol):1-x 1-3x 2x
对于B容器,则
| 3x |
| 1 |
对于C容器,则
| 1×28+1×2 |
| 1-x+1-3x+2x |
对于D容器,则
| 1×28+1×2 |
| 1-x+1-3x+2x |
故答案为:10%;6.25%;11.8%;
(2)由上述分析可知,α(N2)和α(H2)越大,平衡混合气体NH3的含量越大,氮气转化率A>D>B>C,故A容器的NH3的物质的量所占的比例最大,
故答案为:A;
(3)体积越小,压强越大,反应物转化率高,由上述分析可知,氮气转化率A>D>B>C,故体积A<D<B<C,
故答案为:A<D<B<C.
点评:本题考查化学平衡的有关计算,根据平衡移动判断平均相对分子质量或物质的转化率越大压强越大,是解题的关键,难度较大.

练习册系列答案
相关题目
(10分)把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态。分析表中的实验数据后回答有关问题((2)(3)小题用A、B、C、D填空)。
| 容器代码 | A | B | C | D |
平衡时 (混) (混) | | | 16 | 17 |
| 平衡时N2转化率 | 20% | ① | ② | ③ |
| 平衡时H2转化率 | | 30% | | |
(2)都达到平衡时, 容器的NH3的物质的量所占的比例最大。
(3)四个容器的容积由小到大的顺序是 。
(10分)把N2和H2以1:1的物质的量比混合后分成四等份,分别同时充入A、B、C、D四个装有催化剂的真空容器中(四个容器的容积固定,且不等),在保持相同温度的条件下,四容器中的合成氨反应相继达到平衡状态。分析表中的实验数据后回答有关问题((2)(3)小题用A、B、C、D填空)。
|
容器代码 |
A |
B |
C |
D |
|
平衡时 |
|
|
16 |
17 |
|
平衡时N2转化率 |
20% |
① |
② |
③ |
|
平衡时H2转化率 |
|
30% |
|
|
(1)①②③分别为 、 、 。
(2)都达到平衡时, 容器的NH3的物质的量所占的比例最大。
(3)四个容器的容积由小到大的顺序是 。
 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答: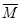 (混)
(混)