题目内容
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
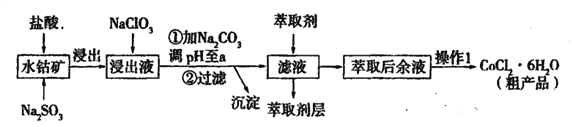
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
【答案】 将钴元素还原到+2价 ClO3-+6Fe2++6H+=Cl-+6Fe3++3 H2O 粉碎矿石(其它合理答案均可) ClO3-+5Cl-+6H+=3Cl2↑+3H2O Fe(OH)3. Al(OH)3 除去溶液中的Mn2+ B 蒸发(浓缩) 冷却(结晶) 粗产品含有可溶性氯化物或晶体失去了部分结晶水(其它合理答案均可)
【解析】试题分析:本题以水钴矿为原料制取CoCl2·6H2O的流程为载体,考查流程的分析,离子方程式的书写,反应条件的选择,图像分析,基本实验操作和误差分析。
(1)①水钴矿中加入盐酸、Na2SO3浸取后浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,此过程中发生的反应有:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O、Fe2O3+SO32-+4H+=2Fe2++SO42-+2H2O、Al2O3+6H+=2Al3++3H2O、MnO+2H+=Mn2++H2O,浸出过程中加入Na2SO3的目的是作还原剂,将Co元素还原到+2价,Fe元素还原为Fe2+。
②向浸出液中加入NaClO3将Fe2+氧化成Fe3+、NaClO3被还原成Cl-,反应可写成ClO3-+Fe2+→Fe3++Cl-,根据得失电子守恒配平为ClO3-+6Fe2+→6Fe3++Cl-,结合原子守恒和溶液呈酸性,写出离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。
③为提高浸取率除了适当增大NaClO3浓度、升高温度,还可以采取的措施粉碎矿石、搅拌等。若不慎向“浸出液”中加入NaClO3过量,过量的NaClO3与Cl-在酸性条件下发生归中反应产生有毒的Cl2,反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O。
(2)①加入NaClO3反应后溶液中主要阳离子为H+、Co2+、Fe3+、Mn2+、Al3+、Na+,根据各阳离子以氢氧化物形成沉淀时的pH分析,“加Na2CO3调pH至a”是除去Fe3+、Al3+,所以过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3。
②浸出液中加入Na2CO3调pH至a除去Fe3+、Al3+,此时溶液中主要阳离子为Co2+、Mn2+、Na+等,则加入萃取剂的作用是除去溶液中的Mn2+,根据图示为了除去Mn2+应使Mn2+的萃取率尽可能高、Co2+的萃取率尽可能低,则适宜的pH范围为3.0~3.5,答案选B。
③萃取后的余液中主要含Co2+、Na+、Cl-等,从萃取后的余液中获得CoCl2·6H2O的“操作1”为蒸发浓缩、冷却结晶、过滤、减压烘干(防止CoCl2·6H2O分解失去结晶水)。
(3)测定CoCl2·6H2O含量的原理:加入AgNO3溶液与Cl-反应形成AgCl沉淀,通过测定AgCl的质量计算CoCl2·6H2O的含量。粗产品中CoCl2·6H2O的质量分数大于100%的原因可能是:粗产品中含可溶性氯化物(如NaCl等)、CoCl2·6H2O晶体失去了部分结晶水。