题目内容
一种碳纳米管能够吸附氢气,可做充电电池(如右图所示)的碳电极,该电池的电解质为6 mol/L KOH溶液,下列说法中正确的是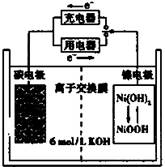
| A.充电时将碳电极与电源的正极相连 |
| B.充电时阴极发生氧化反应 |
| C.放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.放电时碳电极反应为:2H++2e—=H2 ↑ |
C
解析试题分析:A. 碳纳米管能够吸附氢气,可做充电电池的碳电极.放电时H2的电极作负极,发生氧化反应,所以充电时该电极应该与电源的负极相连,作阴极。错误。B.充电时阳极发生氧化反应,阴极发生还原反应。错误。C.放电时镍电极作正极,得到电子,发生还原反应。电极反应式为:NiO(OH)+H2O+e-= Ni(OH)2+OH-。正确。D.放电时碳电极反应为:H2-2e—=2H+.错误。
考点:考查原电池、电解池的电极反应与链接方式的知识。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案通过NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法不正确的是 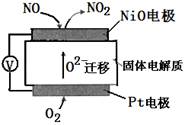
| A.Pt电极是该装置的正极 |
| B.该电池发生的正极反应为:O2 + 4e?+ 2H2O = 4OH? |
| C.负极的电极反应式:NO?2e?+O2?= NO2 |
| D.固体电解质中O2?向负极移动 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是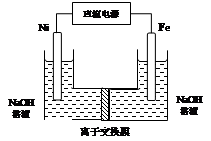
A.铁是阳极,电极反应为Fe-2e-+2OH- Fe(OH)2 Fe(OH)2 |
| B.电解一段时间后,镍电极附近溶液的pH减小 |
| C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- |
| D.每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:N2(g)+2O2(g)=2NO2(g) ΔH="+67.7kJ/mol," 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5+ + OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
镀锌钢管具有广泛的用途,镀锌钢管有冷镀锌管和热镀锌管,冷镀即电镀,热镀是指熔融状态的锌与铁生成合金层。下列说法正确的是
| A.铁锌形成的合金层是纯净物,耐酸碱腐蚀 |
| B.钢管镀锌的目的是使铁与锌形成原电池,消耗锌而保护钢管免受腐蚀 |
| C.钢管冷镀时,钢管作阴极,锌棒作阳极,锌盐溶液作电解质溶液 |
| D.镀锌钢管破损后,负极反应式为Fe-2e-=Fe2+ |
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反
应可表示为2H2+O2=2H2O,下列有关说法正确的是( )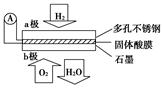
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
据报道,锌电池可能将会取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。则下列叙述正确的是( )。
| A.锌为正极,空气进入负极反应 | B.负极反应为Zn-2e-=Zn2+ |
| C.正极发生氧化反应 | D.电解液为强酸 |
下列有关电池的说法不正确的是( )
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
下列电化学实验装置正确的是( )
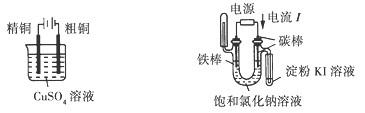 | |
| A.电解精炼铜 | B.验证电解饱和氯化钠溶液 (含酚酞)的产物 |
 | |
| C.在铁制品上镀铜 | D .构成原电池 |