题目内容
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:N2(g)+2O2(g)=2NO2(g) ΔH="+67.7kJ/mol," 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7kJ/mol,下列说法正确的是
| A.N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O=N2H5+ + OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2↑+4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
C
解析试题分析:A、①②两个方程相加除以2可得;B、N2H4不能电离得到OH-;C、N2H4在负极发生氧化反应得到氮气,正确;D、电池总反应式为:N2H4+O2=N2+2H2O,工作一段时间后生成水,氢氧化钾浓度减小,pH将减小。
考点:考查盖斯定律、燃料电池、电极方程式的书写。。

一种碳纳米管能够吸附氢气,可做充电电池(如右图所示)的碳电极,该电池的电解质为6 mol/L KOH溶液,下列说法中正确的是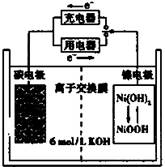
| A.充电时将碳电极与电源的正极相连 |
| B.充电时阴极发生氧化反应 |
| C.放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.放电时碳电极反应为:2H++2e—=H2 ↑ |
科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺——TiO2直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。下列说法错误的是 ( )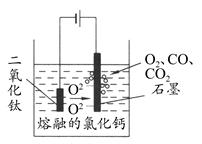
| A.阴极得到钛,电极反应式为TiO2+4e-=Ti+2O2- |
| B.阳极的电极反应式是2O2--4e-=O2↑,生成的部分氧气会将石墨氧化成CO和CO2 |
| C.在工业生产过程中应该不断地更换两极材料 |
| D.该法生产Ti符合绿色环保的要求 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
| A.水既是氧化剂又是溶剂 |
| B.放电时正极上有氢气生成 |
| C.放电时OH-向正极移动 |
| D.总反应为:2 Li+2H2O=2 LiOH+H2↑ |
根据下图回答,下列说法不正确的是 ( )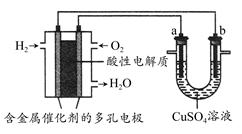
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.燃料电池中正极反应为O2+4e-+4H+=2H2O |
| C.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼 |
| D.电子经导线流入a电极 |
某同学按如图所示的装置进行电解实验。下列说法正确的是( )。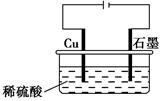
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.放电时转移3 mol e-,有2 mol FeO42-被还原 |
2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32—-2e-=CO2↑+H2O,则下列推断正确的是( )。
| A.电池工作时,CO32—向负极移动 |
| B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极 |
| C.正极的电极反应为4OH--2e-=O2↑+2H2O |
| D.通氧气的电极为正极,发生氧化反应 |
铜锌原电池(如图)工作时,下列叙述正确的是( )
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |