题目内容
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是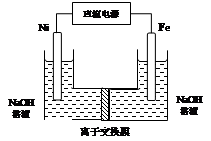
A.铁是阳极,电极反应为Fe-2e-+2OH- Fe(OH)2 Fe(OH)2 |
| B.电解一段时间后,镍电极附近溶液的pH减小 |
| C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- |
| D.每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
C
解析试题分析:用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4),铁失电子生成高铁酸钠,则铁作阳极,镍作阴极,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,所以电极反应式为Fe-2e-+2OH-═Fe(OH)2,故A正确;镍电极上氢离子放电生成氢气,氢离子浓度减小,所以溶液的pH增大,故B错误;若离子交换膜为阴离子交换膜,阴离子向阳极移动,则电解结束后右侧溶液中含有FeO42-,故C错误;温度和压强未知,所以无法计算生成气体体积,故D错误;故选A。
考点:本题考查电解原理,正确判断阴阳极及发生的反应是解本题关键。

 阅读快车系列答案
阅读快车系列答案一种碳纳米管能够吸附氢气,可做充电电池(如右图所示)的碳电极,该电池的电解质为6 mol/L KOH溶液,下列说法中正确的是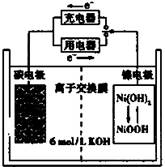
| A.充电时将碳电极与电源的正极相连 |
| B.充电时阴极发生氧化反应 |
| C.放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.放电时碳电极反应为:2H++2e—=H2 ↑ |
氯碱工业中关于电极材料的选用,下列说法合理的是 ( )。
| A.两极可用任意可导电固体材料 |
| B.阳极必须用惰性电极 |
| C.阴极必须用惰性电极 |
| D.石墨阳极比金属阳极更节电 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
| A.水既是氧化剂又是溶剂 |
| B.放电时正极上有氢气生成 |
| C.放电时OH-向正极移动 |
| D.总反应为:2 Li+2H2O=2 LiOH+H2↑ |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。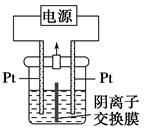
已知:3I2+6OH-=IO3—+5I-+3H2O
下列说法不正确的是 ( )。
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含IO3— |
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
根据下图回答,下列说法不正确的是 ( )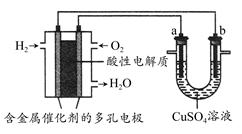
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.燃料电池中正极反应为O2+4e-+4H+=2H2O |
| C.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼 |
| D.电子经导线流入a电极 |
某同学按如图所示的装置进行电解实验。下列说法正确的是( )。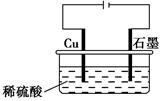
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
如图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。下列关于此装置的叙述中,不正确的是( )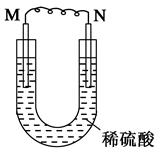
| A.N上有气体放出 |
| B.M为负极,N为正极 |
| C.化学能转变为电能的装置 |
| D.导线中有电流通过,电流方向由M到N |
