题目内容
镀锌钢管具有广泛的用途,镀锌钢管有冷镀锌管和热镀锌管,冷镀即电镀,热镀是指熔融状态的锌与铁生成合金层。下列说法正确的是
| A.铁锌形成的合金层是纯净物,耐酸碱腐蚀 |
| B.钢管镀锌的目的是使铁与锌形成原电池,消耗锌而保护钢管免受腐蚀 |
| C.钢管冷镀时,钢管作阴极,锌棒作阳极,锌盐溶液作电解质溶液 |
| D.镀锌钢管破损后,负极反应式为Fe-2e-=Fe2+ |
C
解析试题分析:A.铁锌形成的合金层是混合物,合金比成分金属具有更多优良的性能。错误。 B.钢管镀锌的目的一是美观,二是万一镀层被破坏,由于铁与锌形成原电池,腐蚀消耗的任然是锌而保护钢管免受腐蚀。错误。C.钢管冷镀时,镀件钢管作阴极,镀层金属锌棒作阳极,含有Zn2+的锌盐溶液作电解质溶液。正确。D.镀锌钢管破损后,负极反应式为Zn-2e-=Zn2+。错误。
考点:考查合金的的性质及电镀的反应原理、电极反应的知识。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案一种碳纳米管能够吸附氢气,可做充电电池(如右图所示)的碳电极,该电池的电解质为6 mol/L KOH溶液,下列说法中正确的是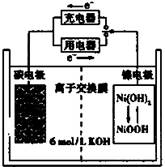
| A.充电时将碳电极与电源的正极相连 |
| B.充电时阴极发生氧化反应 |
| C.放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.放电时碳电极反应为:2H++2e—=H2 ↑ |
下列防腐措施中,属于化学保护法的为 ( )。
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的船壳吃水线以下部分,装上锌块 |
| D.金属表面喷漆 |
根据下图回答,下列说法不正确的是 ( )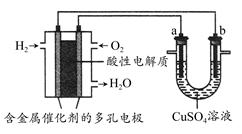
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.燃料电池中正极反应为O2+4e-+4H+=2H2O |
| C.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼 |
| D.电子经导线流入a电极 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.放电时转移3 mol e-,有2 mol FeO42-被还原 |
已知空气锌电池的电极反应为
锌片:Zn+2OH--2e-=ZnO+H2O;
碳棒: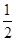 O2+H2O+2e-=2OH-,
O2+H2O+2e-=2OH-,
据此判断,锌片是( )。
| A.正极并被还原 | B.正极并被氧化 | C.负极并被还原 | D.负极并被氧化 |
2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32—-2e-=CO2↑+H2O,则下列推断正确的是( )。
| A.电池工作时,CO32—向负极移动 |
| B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极 |
| C.正极的电极反应为4OH--2e-=O2↑+2H2O |
| D.通氧气的电极为正极,发生氧化反应 |
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
| A.原电池放电时,负极上发生反应的物质是Zn |
| B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2 |
| C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
电解原理在化学工业中有着广泛的应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。则下列说法不正确的是( )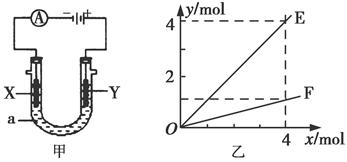
| A.若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 |
| B.按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 |
| C.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol |
| D.若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol·L-1 |