题目内容
下列粒子半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:同种元素的阳离子半径小于原子半径,同种元素的阴离子半径大于原子半径,同周期元素的原子半径从左向右在减小,电子排布相同的微粒,原子序数越大,则离子半径越小,以此来解答.
解答:
解:A.因同种元素的阳离子半径小于原子半径,则
小于1,故A错误;
B.因同种元素的阴离子半径大于原子半径,则
小于1,故B错误;
C.Na、Mg都在同周期,同周期元素的原子半径从左向右在减小,则
大于1,故C正确;
D.电子排布相同的微粒,原子序数越大,则离子半径越小,则
小于1,故D错误;
故选C.
| r(Na+) |
| r(Na) |
B.因同种元素的阴离子半径大于原子半径,则
| r(Cl) |
| r(Cl-) |
C.Na、Mg都在同周期,同周期元素的原子半径从左向右在减小,则
| r(Na) |
| r(Mg) |
D.电子排布相同的微粒,原子序数越大,则离子半径越小,则
| r(Mg2+) |
| r(O2-) |
故选C.
点评:本题考查微粒半径的比较,明确原子半径的比较方法、离子半径与原子半径的关系即可解答,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
下列叙述中,错误的是( )
| A、甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
| B、苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
| C、乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
| D、苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 |
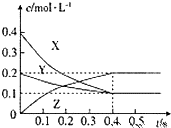 在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )| A、反应可表示为3X+Y?2Z |
| B、从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol?L-1?s-1 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、升高温度,平衡常数可能增大也可能减小 |
分子式为C4H8Cl2的有机物,分子中含2个甲基的同分异构体有(不含立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
只用一种试剂来鉴别NaOH、Ba(OH)2、稀盐酸三种溶液,这种试剂是( )
| A、硫酸钠溶液 |
| B、氯化镁溶液 |
| C、碳酸钠溶液 |
| D、硝酸银溶液 |
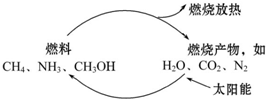 能是当今社会发展的三大支柱之一,有专家提出:如果对燃料燃烧产物如CO2、H2O、N2等利用太阳能让它们重新组合,使之能够实现下图所示循环,那么不仅可以消除燃烧产物对大气的污染,还可节约燃料,缓解能危机.在此构想的物质循环中太阳能最终转化为( )
能是当今社会发展的三大支柱之一,有专家提出:如果对燃料燃烧产物如CO2、H2O、N2等利用太阳能让它们重新组合,使之能够实现下图所示循环,那么不仅可以消除燃烧产物对大气的污染,还可节约燃料,缓解能危机.在此构想的物质循环中太阳能最终转化为( )| A、化学能 | B、热能 |
| C、生物质能 | D、电能 |
分别测得反应2SO2+O2
2SO3的速率如下,其中最快的是( )
| ||
| △ |
| A、v(SO2)=4 mol/(L?min) |
| B、v(O2)=3 mol/(L?min) |
| C、v(SO2)=0.1 mol/(L?s) |
| D、v(O2)=0.1 mol/(L?s) |