题目内容
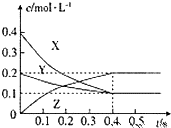 在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )| A、反应可表示为3X+Y?2Z |
| B、从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol?L-1?s-1 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、升高温度,平衡常数可能增大也可能减小 |
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的影响因素
专题:化学平衡专题
分析:A.由图象可知,X和Y的物质的量浓度减小,Z的物质的量浓度增加,则X和Y为反应物,Z为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(X):△c(Y):△c(Z)=(0.4-0.1)mol/L:(0.2-0.1)mol/L:0.2mol/L=3:1:2,则反应的化学方程式为3X+Y?2Z;
B.根据v=
计算Y表示的化学反应速率;
C.若增大压强,平衡向体积减小的方向移动,反应速率变大;
D.根据图象不能确定反应热,不能判断温度对平衡移动的影响.
B.根据v=
| △c |
| △t |
C.若增大压强,平衡向体积减小的方向移动,反应速率变大;
D.根据图象不能确定反应热,不能判断温度对平衡移动的影响.
解答:
解:A.由图象可知,X和Y的物质的量浓度减小,Z的物质的量浓度增加,则X和Y为反应物,Z为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(X):△c(Y):△c(Z)=(0.4-0.1)mol/L:(0.2-0.1)mol/L:0.2mol/L=3:1:2,则反应的化学方程式为3X+Y?2Z,故A正确;
B.根据v=
可得,Y表示的化学反应速率=
=0.25 mol?L-1?s-1,故B正确;
C.若增大压强,平衡向气体体积减小的方向移动,对于反应3X+Y?2Z平衡向生成Z的方向移动,同时由于压强增大,所有物质的浓度都增大,所以正逆反应速率都变大,但平衡常数不变,故C错误;
D.根据图象不能确定反应热,所以不能判断温度对平衡移动的影响,也就无法判断温度对化学平衡常数的影响,故D正确;
故选C.
B.根据v=
| △c |
| △t |
| (0.2-0.1)mol/L |
| 0.4 s |
C.若增大压强,平衡向气体体积减小的方向移动,对于反应3X+Y?2Z平衡向生成Z的方向移动,同时由于压强增大,所有物质的浓度都增大,所以正逆反应速率都变大,但平衡常数不变,故C错误;
D.根据图象不能确定反应热,所以不能判断温度对平衡移动的影响,也就无法判断温度对化学平衡常数的影响,故D正确;
故选C.
点评:本题考查化学平衡图象问题,题目难度中等,注意根据图象书写反应的化学方程式,图是物质的量浓度的变化曲线,不能判断温度对平衡移动的影响.

练习册系列答案
相关题目
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH值逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液.
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液.
| A、①③⑤ | B、②④⑤ |
| C、②④ | D、②④⑥ |
实验室里吸收SO2最好选( )
| A、饱和食盐水 |
| B、氯化钡溶液 |
| C、氢氧化钠溶液 |
| D、澄清石灰水 |
下列叙述中,正确的是( )
| A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B、两种原子,如果核外电子排布相同,则它们的关系为互为同位素 |
| C、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| D、阴离子的核外电子排布与上周期稀有气体元素原子的核外电子排布相同 |
下列粒子半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列各组离子在相应的条件下可能大量共存的是( )
| A、能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | ||
| B、由水电离产生的c(OH-)=1×10-10mol?L-1的溶液中:NO3-、Mg2+、Na+、SO42- | ||
C、在
| ||
D、
|
下列关于有机化合物的说法正确的是( )
| A、乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| B、汽油、乙烯均为石油分馏产品 |
| C、可以用分液的方法分离硝基苯和苯 |
| D、有机化合物都能燃烧 |