题目内容
【题目】实验室合成苯甲酸的原理、有关数据及装置示意图如图:
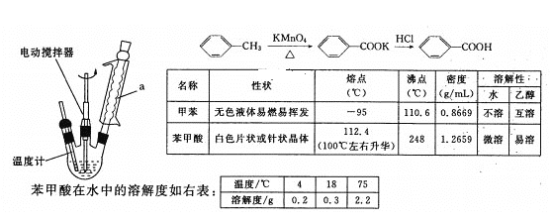
某学习小组在实验室制备、分离、提纯苯甲酸,步骤如下:
(一)制备苯甲酸
在三颈瓶中加入甲苯、水和沸石,搅拌并加热至沸腾,然后加入过量高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
(二)分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,减压过滤,再用少量冷水洗涤,干燥,得到粗产品。
请回答下列问题:
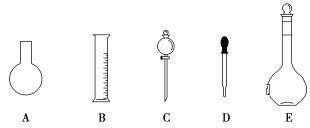
(1)装置a的名称是__,其作用为__。
(2)甲苯被高锰酸钾氧化的原理如下,请完成并配平该化学方程式。
________![]() +________KMnO4
+________KMnO4![]() ________
________![]() +________MnO2↓+________H2O+___________
+________MnO2↓+________H2O+___________
(3)分离提纯过程中为了除去过量的KMnO4,加入一种二元弱酸草酸,反应过程中有碳酸氢盐和无色气体生成。请用离子方程式表示反应原理__。
(4)产品减压过滤时用冷水洗涤的原因是__。
(5)选用下列_操作,可以将粗产品进一步提纯(选填字母)。
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(6)以酚酞为指示剂,用标准浓度KOH溶液滴定苯甲酸的乙醇溶液,可测定产品纯度,滴定终点的现象是__。
【答案】球形冷凝管 冷凝回流,防止甲苯的挥发而降低产品产率 1 2 1 2 1 1 KOH 2MnO4-+3H2C2O4=2MnO2↓+2HCO3-+4CO2↑+2H2O 苯甲酸在冷水中的溶解度较小,用冷水洗涤可以减少产品的损失 D 溶液由无色变浅红色,且半分钟不褪色
【解析】
(1)苯甲酸是易燃易挥发的液体,甲苯液体加热至沸腾时甲苯挥发降低其利用率,故需用装置a(球形冷凝管)将甲苯蒸汽冷凝回流,防止甲苯的挥发而降低产品产率;
(2)根据氧化还原反应的原理可配平该化学方程式: ![]() +2KMnO4
+2KMnO4![]()
![]() +2MnO2↓+H2O+KOH;
+2MnO2↓+H2O+KOH;
(3)H2C2O4具有还原性,可将过量的KMnO4还原为MnO2而过滤除去,H2C2O4被KMnO4氧化为KHCO3和CO2,根据氧化还原反应的原理可得反应的离子方程式为:2MnO4-+3H2C2O4=2MnO2↓+2HCO3-+4CO2↑+2H2O ;
(4)由表中苯甲酸在水中的溶解度表可知,苯甲酸在冷水中的溶解度较小,将苯甲酸晶体用冷水洗涤可以减少产品的损失;
(5)由表中苯甲酸的性质可知,苯甲酸在100℃左右升华,KCl的熔沸点很高,不升华,所以提纯含有氯化钾的苯甲酸可以采用升华的方法得到较纯的苯甲酸;
(6)向苯甲酸的乙醇溶液中滴加酚酞,溶液无色,用标准浓度KOH溶液滴定,当溶液呈浅红色且半分钟内不褪色时,说明达到滴定终点。

 阅读快车系列答案
阅读快车系列答案【题目】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
pH | 8 | 10 | 12 | 1 4 |
温度/℃ | 25 | 25 | 25 | 25 |
时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
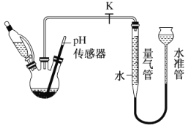
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。