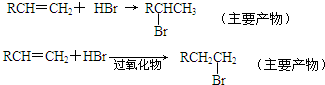
题目内容
19.16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度500℃,最后容器内剩余的固体物质是( )| A. | Na2CO3 | B. | Na2CO3、Na2O2 | C. | NaHCO3、Na2CO3 | D. | Na2CO3、NaOH |
分析 n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,发生的反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑、2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,H2O、CO2混合和Na2O2反应时,CO2先反应、H2O后反应,据此分析解答.
解答 解:n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,发生的反应为
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑、2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,H2O、CO2混合和Na2O2反应时,CO2先反应、H2O后反应,
0.2mol碳酸氢钠分解生成0.1molH2O、0.1molCO2,0.1molCO2完全反应需要0.1molNa2O2,水蒸气不反应,所以最终得到的固体是Na2CO3,故选A.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确反应先后顺序是解本题关键,为易错题.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
18.下列说法不正确是( )
| A. | 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用胶头滴管,逐滴加入至刻度 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| C. | N2O5在四氯化碳溶液中分解为NO2和O2,可用分光光度计测定其化学反应速率 | |
| D. | 物质的分离提纯方法之一为“筛分:如胶体--半透膜法分离提纯;悬浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的筛子 |
19.下列关于生活中的现象及仪器的使用的说法不正确的是( )
| A. | “酸可除锈”、“纯碱溶液可去油污”都发生了化学变化 | |
| B. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 滴定管以及容量瓶在使用前需检查是否漏水 |
7.已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11.下列说法正确的是( )
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
11.一个原电池的总反应的离子方程式是:Fe+2H+=Fe2++H2↑,实现该反应的原电池的正确组成是( )
| A | B | C | D | |
| 正极 | Fe | Fe | C | Cu |
| 负极 | Cu | Zn | Fe | Fe |
| 电解质溶液 | HNO3 | H2SO4 | HCl | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
9.下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-) (均用实际的元素符号表示).
比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bcd(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的PH值来鉴别.
| 元素性质[] | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-) (均用实际的元素符号表示).
比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bcd(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的PH值来鉴别.

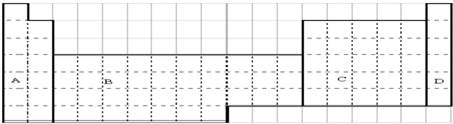
 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题: ;
; .
.