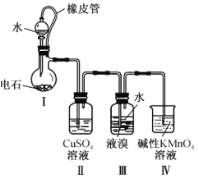
题目内容
【题目】常温下,用0.10mol·L-1KOH溶液滴定10.00mL0.10mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积看成两者溶液的体积之和),下列说法正确的是
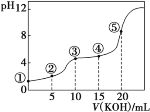
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.15mol·L-1
D.点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
【答案】D
【解析】
A. 点②所示溶液中存在电荷守恒:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A错误;
B. 点③所示溶液为KHC2O4溶液,此时pH<7,则HC2O4-电离大于水解,c(C2O42-)>c(H2C2O4),c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故B错误;
C. 点④所示溶液为0.02mol·L-1KHC2O4和0.02mol·L-1K2C2O4的混合液, 根据物料守恒可知c(K+)= 0.06mol·L-1,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol·L-1,则c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10mol·L-1,故C错误;
D. 点⑤所示溶液为K2C2O4溶液存在质子守恒:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故D正确;
故答案选:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
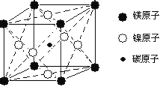
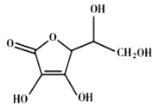
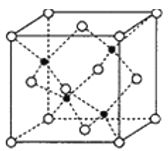
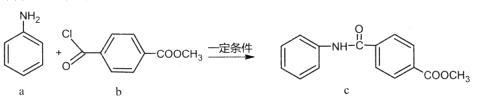
小学生10分钟应用题系列答案【题目】茉莉醛被广泛应用于食品、化妆品和洗涤剂中。实验室制备茉莉醛的反应:![]() +CH3(CH2)5CHO
+CH3(CH2)5CHO![]()
![]() +H2O,有关数据如下表:
+H2O,有关数据如下表:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |
实验室制备茉莉醛的装置示意图如下:

实验步骤:
在a中加入5.30 mL苯甲醛、5 mL95%乙醇、12 mL10%KOH溶液,在c中加入6.84 g庚醛。搅拌并加热至60~65℃,打开c向a中缓慢滴加庚醛。保温搅拌反应3 h。反应待冷却后,静置分层,分出有机层,水层用20 mL二氯甲烷分两次萃取,萃取分液后与有机层合并,有机层再用10 mL水洗涤3次,洗涤后加入无水Na2SO4。蒸馏,收集287~290℃馏分,馏分用柱色谱法进行分离,得纯净的茉莉醛4.04g。已知:柱色谱分离中,先将液体样品从柱顶加入,流经吸附柱时,即被吸附在柱的上端,然后从柱顶加入洗脱剂,由于吸附剂对各组分吸附能力不同,各组分以不同速度沿柱下移,从而达到分离的效果。
回答下列问题:
(1)仪器a的名称是___________,实验中应采取的加热方法是___________。
(2)在洗涤操作中,用水洗涤的主要目的是________,加入无水Na2SO4的目的是________。
(3)用二氯甲烷萃取分液时,水层在_____(填“上”或“下”)层。
(4)柱色谱法分离中使用的吸附剂为硅胶或碳酸钙,除此之外,还可以使用_______(填序号)
①活性炭 ②氯化钠 ③氧化铝 ④碳酸钾
(5)柱色谱法分离过程中,如果洗脱剂加入速度太快,会使产品产率_______(填“偏高”、“不变”、“偏低”)
(6)本实验所得茉莉醛产率为______%。
【题目】CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如表所示:
CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
I(恒温恒容) | 2 | 6 | 0 | 0 |
II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)___________K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___________c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(![]() )如图所示:
)如图所示:
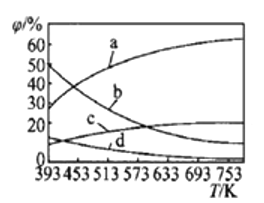
①曲线b、c表示的物质分别为___________、___________(填化学式)。
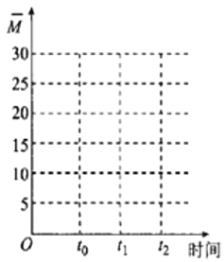
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________。