题目内容
【题目】CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
CH3OH(g)+H2O(g) △H=___________kJ·mol-1。有利于提高H2平衡转化率的条件是___________(填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________(保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如表所示:
CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
I(恒温恒容) | 2 | 6 | 0 | 0 |
II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)___________K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___________c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(![]() )如图所示:
)如图所示:
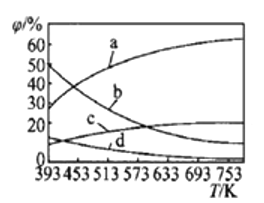
①曲线b、c表示的物质分别为___________、___________(填化学式)。
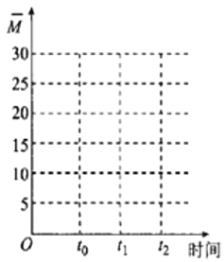
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________。
【答案】-51.7 B 0.05 < < H2O CO2 
【解析】
(1)①H2燃烧的热化学方程式为①H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
CH3OH燃烧的热化学方程式为:②CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol
③CH3OH(1)===CH3OH (g) △H=+35.2kJ·mol-1;
④H2O(1)===H2O(g) △H=+44kJ·mol-1。
将得①×3-②+③+④,得CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的△H=-51.7 kJ·mol-1。该反应的特点是正向放热,气体分子总数减少,所以低温、高压均可以使平衡右移,对提高氢气的转化率有利,所以选择B项。
CH3OH(g)+H2O(g)的△H=-51.7 kJ·mol-1。该反应的特点是正向放热,气体分子总数减少,所以低温、高压均可以使平衡右移,对提高氢气的转化率有利,所以选择B项。
②先以物质的量数据代入列出“三段式”:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
初始 4 6 0 0
变化 1 3 1 1
平衡 3 3 1 1
容器的体积为2L,所以平衡时CO2、H2、CH3OH、H2O的物质的量浓度(mol/L)分别为:1.5、1.5、0.5、0.5,据平衡常数的本义式有:![]() ==
==![]() =0.05。
=0.05。
③从题给表格中数据来看,如若二者温度相同,则两个容器为完全等同的两个平衡——一个从反应物投料,一个从产物投料而已。现一个为恒温,一个为绝热,又由于该反应是正向放热的反应,容器II从产物开始投料,反应过程中吸热,导致温度比容器I的要降低。而温度越低,平衡常数越大,所以KI<KII。容器II的反应相当于在容器I的基础上右移,所以平衡时CH3OH的浓度:c(I)<c(Ⅱ);2)①反应2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1,正向是一个放热反应,升温,平衡应左移,所以所给图示中,含量减少的b、d是生成物,增加的a、c是反应物,因按n(CO2)︰n(H2)=1︰3的投料而且体积固定,所以a为H2、b为水、c为CO2,d为乙烯,所以答案为H2O、CO2;②反应前混合气体的平均相对分子质量为:
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1,正向是一个放热反应,升温,平衡应左移,所以所给图示中,含量减少的b、d是生成物,增加的a、c是反应物,因按n(CO2)︰n(H2)=1︰3的投料而且体积固定,所以a为H2、b为水、c为CO2,d为乙烯,所以答案为H2O、CO2;②反应前混合气体的平均相对分子质量为:![]() =18.8,所以起点坐标为(0,18.8),随着反应的进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,如全部转化为乙烯和水,平均相对分子质量为
=18.8,所以起点坐标为(0,18.8),随着反应的进行,气体的物质的量减小,混合气体的平均相对分子质量增大,至t0时达到化学平衡,如全部转化为乙烯和水,平均相对分子质量为![]() 。t1瞬间扩大至2VL并保持不变,t2时重新达到平衡,平均相对分子质量减小,t2时达平衡时相对分子质量应大于18.8。所以图象为:
。t1瞬间扩大至2VL并保持不变,t2时重新达到平衡,平均相对分子质量减小,t2时达平衡时相对分子质量应大于18.8。所以图象为:


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案