题目内容
10.下列有关物质用途的说法中,不正确的是( )| A. | 氨可用作致冷剂 | |
| B. | 漂白粉可用作环境的消毒剂 | |
| C. | 铝制容器常温下可盛装浓硝酸 | |
| D. | 二氧化硅是将太阳能转化为电能的常用材料 |
分析 A.氨气易液化;
B.漂白粉具有强氧化性;
C.常温下Al遇浓硝酸发生钝化;
D.二氧化硅不导电,Si为良好的半导体材料.
解答 解:A.氨气易液化,则氨可用作致冷剂,故A正确;
B.漂白粉具有强氧化性,则漂白粉可用作环境的消毒剂,故B正确;
C.常温下Al遇浓硝酸发生钝化,生成致密的氧化膜阻止内部金属被腐蚀,则铝制容器常温下可盛装浓硝酸,故C正确;
D.二氧化硅不导电,Si为良好的半导体材料,则Si是将太阳能转化为电能的常用材料,故D错误;
故选D.
点评 本题考查元素化合物知识,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.按照物质的树状分类法和交叉分类法,对于H2SO4的分类正确的是( )
①酸; ②氧化物; ③氢化物; ④强酸; ⑤含氧酸;⑥难挥发性酸; ⑦一元酸; ⑧化合物; ⑨混合物.
①酸; ②氧化物; ③氢化物; ④强酸; ⑤含氧酸;⑥难挥发性酸; ⑦一元酸; ⑧化合物; ⑨混合物.
| A. | ①④⑤⑥⑧ | B. | ①②④⑤⑥⑦⑧ | C. | ①③④⑤⑥⑨ | D. | ①④⑤⑥⑦⑨ |
18.如图所示装置,能够组成原电池且有气泡产生的是( )
| A. | 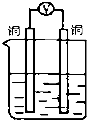 稀硫酸 | B. | 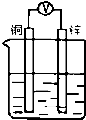 稀硫酸 | C. | 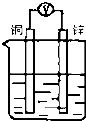 硫酸铜溶液 | D. |  乙醇溶液 |
5.当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A. | 硅酸溶胶 | B. | 氯化钠溶液 | C. | 氯化铁溶液 | D. | 硫酸铜溶液 |
15.下列物质在水溶液状态下电离方程式错误的是( )
| A. | Na2CO3═2Na++CO32- | B. | Al2(SO4)3═2 Al3 ++3SO42- | ||
| C. | H2CO3?2H++HCO3- | D. | NH3•H2O?NH4++OH- |
2.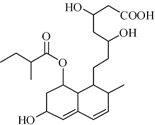 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 1mol该物质与1molBr2发生加成反应,产物有2种 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与1molNaOH反应 |
19.在化学反应 A(g)+3B(g)?2C (g)+D(g)中,A、B、C、D的平均反应速率分别为v1、v2、v3、v4,则下列关系正确的是( )
| A. | v1=v2 | B. | v1=2v3 | C. | v3=3v2 | D. | v1=v4 |
4.下列关于影响化学反应速率因素的解释不正确的是( )
| A. | 若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大 | |
| B. | 若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大 | |
| C. | 若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高→有效碰撞次数增多→化学反应速率增大 | |
| D. | 若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大 |
 (2)氮原子
(2)氮原子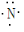 (3)Na2S
(3)Na2S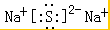 (4)H2O
(4)H2O .
.