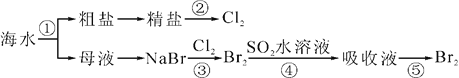
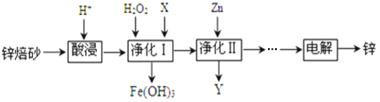
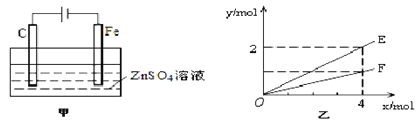
��Ŀ����
����Ŀ�������ʽṹ�����ʣ��ڻ�ҩ���ҹ��Ŵ����Ĵ���֮һ���ڻ�ҩ��ըʱ�����ķ�ӦΪ:
2KNO3+S+3C=K2S+N2��+3CO2�����ش��������⣺
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ____________����һ�����ܣ�K____________(�>����<��)Na��
��2��NO3-�Ŀռ乹��Ϊ_____________��
��3����̬��������CS2���۵�Ϊ112�棬�е�Ϊ444.8�档����ӽṹΪ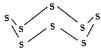 ��S8����ԭ�ӵ��ӻ����������____________��S8������������________����ԭ�Ӵ���ͬһƽ�档
��S8����ԭ�ӵ��ӻ����������____________��S8������������________����ԭ�Ӵ���ͬһƽ�档
��4��N2�����������������ĸ�����Ϊ___________����N2�ķе��CO�ķе�__________����ߡ������͡�����
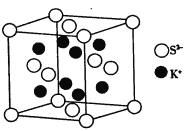
��5��K2S�ľ����ṹ��ͼ��ʾ������K+����λ��Ϊ_____________��S2-����λ��Ϊ__________���������о������������S2-�˼��Ϊacm����K2S������ܶ�Ϊ__________g��cm-3���г�����ʽ�����ؼ�����������
���𰸡�
��1��ls22s22p63s23p64s1(2��)����(1��)
��2��ƽ���������Σ�1�֣�
��3��sp3��1�֣���4(2��)
��4��1��2��1�֣����ͣ�1�֣�
��5��4��2�֣���8��2�֣���![]() (2��)
(2��)
��������
���������
��1����Ϊ�ڵ������ڵڢ�A�塣��̬��ԭ�ӵĺ�������Ų�ʽΪls22s22p63s23p64s1��[Ar]4s1����ͬ����Ԫ�ص�һ�����������������μ�С�����Ե�һ�����ܣ�K��Na��
��2����������ԭ�ӵļ۲���ӶԻ������ۣ�NO3-�ļ۲���Ӷ���Ϊ3�ԣ����µ��Ӷԣ���ռ乹��Ϊƽ���������Ρ�
��3������S8�ķ��ӽṹ��֪��ÿ��Sԭ�ӵļ۵��Ӷ���Ϊ4�ԣ�������ԭ�ӵ��ӻ����������sp3��S8������������4����ԭ�Ӵ���ͬһƽ�档
��4��N2�������γɵ����������Ҽ���м��ĸ�����Ϊ1��2��N2��CO����Է���������Ϊ28����N2Ϊ�Ǽ��Է��ӣ�COΪ���Է��ӣ�����N2�ķе��CO�ķе�͡�
��5��K2S�ľ����У�ÿ��K+��Χ�Ⱦ������S2-��4��������K+����λ��Ϊ4��ÿ��S2��Χ�Ⱦ������K+��8��������S2-����λ��Ϊ8��
�����о������������S2-�˼��Ϊacm��Ϊÿ����Խ��߾����һ�룬���ı߳�Ϊ![]() acm������K2S������ܶ�Ϊ��=
acm������K2S������ܶ�Ϊ��=![]() =
=![]() ��
��

 �߽�������ϵ�д�
�߽�������ϵ�д�����Ŀ������������Ϊ36.5%�����ᣨ�ܶ�Ϊ1.16gcm��3������1molL��1��ϡ���ᣮ��ʵ���ҽ���Ҫ��������220mL���Իش��������⣺
��1������ϡ����ʱ�������õ���Ͳ���ձ�������������ͷ�ιܣ�����ʹ�õIJ��������� ��
��2��������֪��������ʵ���Ũ��Ϊ ��
��3����������Ҫ mLŨ���ᣬ����ȡʱ��ѡ��������Ͳ�е� ��
A��5mL | B��10mL | C��25mL | D��50mL |
��4������ȡŨ������������в�����
����ϡ�͵�������¶�������һ�º��ز�����ע��250mL����ƿ�С�
��������ƿ��С�ļ�����ˮ��Һ��������ƿ�̶���1��2cmʱ�����ý�ͷ�ιܼ�����ˮ��ʹ��Һ��Һ����ƿ���Ŀ̶ȱ������С�
����ʢ������ձ���ע������ˮ�����ò�����������ʹ���Ͼ��ȡ�
��������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ��
���������У���ȷ��˳���ǣ�����ţ� ��
��5�����������ƹ����У�������ʱˮ�Ӷ���õι���������IJ��֣������Ƶ�ϡ����Ũ���� ������ƫ��������ƫ����������Ӱ��������������ʱ���ӿ̶��ߣ������Ƶ�ϡ����Ũ���� ������ƫ��������ƫ����������Ӱ��������