题目内容
4.以下是某同学测定硫酸钠晶体中结晶水含量的实验方案.实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量.重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数.
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是坩埚钳、酒精灯;
(2)指出实验步骤中存在的错误并改正步骤②有错误,应先将试样研细,后放入坩埚称重;
(3)硫酸钠不能放置在空气中冷却的原因是因硫酸钠放置在空气中冷却时,会吸收空气中的水分;
(4)步骤⑤的目的是保证样品中的结晶水已经全部除去;
(5)下面的情况有可能造成测试结果偏高的是BDF(填序号).
A.试样中含有加热不挥发的杂质 B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水 D.实验前坩埚未完全干燥
E.晶体加热脱水不完全 F.加热时有晶体溅出.
分析 (1)首先根据实验步骤中的各步操作,确定所需的实验仪器,将盛有试样的坩埚加热需要坩埚钳、酒精灯等,而这些仪器在试题所提供的仪器中并没有出现,因此可确定它们是所缺少的实验用品.
(2)为了保证称量准确,步骤②有错误,应先将称量的试样放入研钵中研细,再放回到坩埚中称重;
(3)本实验为定量实验,对准确性的要求较高.在加热后冷却时,为了防止硫酸钠吸水,应将硫酸钠放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸钠.
(4)将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量,重复本操作,直至两次称量结果不变,这是为了确定样品中结晶水已经被全部除去;
(5)在测定中若被测样品中含有加热易挥发的杂质或实验前坩埚未完全干燥或者加热时有硫酸钠损失,都会造成测量结果偏高.
解答 解:(1)根据实验步骤,将盛有试样的坩埚加热需要坩埚钳、酒精灯,而这些仪器在试题所提供的仪器中并没有出现,故答案为:坩埚钳、酒精灯;
(2)为了保证称量准确,步骤②有错误,应先将称量的试样放入研钵中研细,再放回到坩埚中称重,故答案为:步骤②有错误,应先将试样研细,后放入坩埚称重;
(3)在加热后冷却时,为了防止硫酸钠吸水,应将硫酸钠放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸钠,所以硫酸钠不能放置在空气中冷却的原因是因硫酸钠放置在空气中冷却时,会吸收空气中的水分;故答案为:因硫酸钠放置在空气中冷却时,会吸收空气中的水分;
(4)实验中的加热、冷却、称量的操作步骤要重复进行,直至两次称量结果不变,这是为了确定样品中结晶水已经被全部除去,这样做是为了保证定量实验的准确性.故答案为:保证样品中的结晶水已经全部除去;
(5)A、被测样品中含有加热不挥发的杂质会导致测定的水的质量偏小,故A错误;
B、被测样品中含有加热易挥发的杂质会导致测定结果偏大,故B正确;
C、实验前被测样品已有部分失水会导致测定的水的质量偏小,故C错误;
D、加热前所用的坩埚未完全干燥,加热后水挥发,导致水的质量测定结果偏大,故D正确;
E、晶体加热脱水不完全,会导致测定的水的质量偏小,故E错误;
F、加热时有晶体溅出,导致水的质量测定结果偏大,故F正确.
故答案为:BDF.
点评 本题是一道定量实验题,既要学生分析实验的关键、细节,又要求对实验结果产生的误差的原因进行分析.既考查了学生对化学实验的基本操作和常见仪器的认识和使用,又考查了学生分析问题和解决问题的能力.从题目本身对学生的实验能力要求较高,但此题实际上就来源于课本的学生实验,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉、很简单.

(1)将PM2.5样本用蒸馏水处理制成待测试样,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)洗涤含SO2的烟气,下列物质可作洗涤剂的是bc
a.CaCl2 溶液 b.Na2CO3 溶液 c.Ca(OH)2 悬浊液 d.浓H2SO4
(3)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g);△H<0
①该反应平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;温度升高K值减小(填“增大”或“减小”)
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是bd.
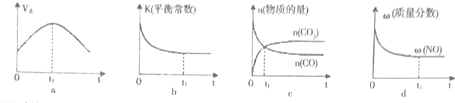
(4)汽车尾气中NOx和CO的生成及转化.
①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H>0,判断该设想能否实现:不能(填“能”或“不能”),简述其依据:;△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
| A. |  | B. |  | C. |  | D. |  |
| A. | 室内着火马上开门窗 | B. | 炒菜时油锅着火用锅盖盖灭 | ||
| C. | 用明火检验燃气是否泄漏 | D. | 电器着火时用水浇灭 |
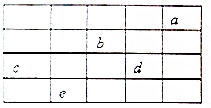 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的天然氧化物可被称为刚玉 | |
| C. | b、d气态氢化物溶于水,溶液的酸性:b>d | |
| D. | c、d气态氢化物的稳定性:d>c |
| A. | 加水稀释,氨水溶液中导电粒子的数目减少 | |
| B. | 通入HCl气体,氨水溶液中NH3•H2O的电离平衡向右移动,溶液的pH增大 | |
| C. | 由0.1mol/L一元碱BOH溶液的 pH=10,可推知BOH溶液中存在BOH═B++OH- | |
| D. | 由0.1mol/L一元酸HA溶液的 pH=3,可推知NaA溶液中存在A-+H2O═HA+OH- |
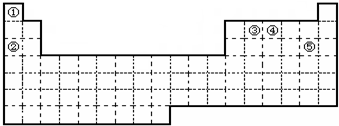
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 只由这四种元素不能组成有机化合物 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
| A. | CO2分子比例模型: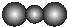 | B. | NH4I的电子式: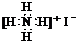 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | K+最外层电子排布式:4S24P6 |
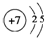 ,
,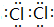 .
.