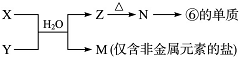
题目内容
13.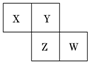 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 只由这四种元素不能组成有机化合物 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.结合元素性质的递变规律分析解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.
A、同周期从左到右元素的非金属性增强,则非金属性W>Z,非金属性越强,最高价氧化物对应水化物的酸性越强,所以W的最高价氧化物对应水化物的酸性比Z的强,故A错误;
B、X为氮元素,Y为氧元素,Z为硫元素,W为氯元素,有机物一定含有碳元素,只由这四种元素不能组成有机化合物,故B正确;
C、同主族元素从上到下非金属性减弱,则非金属性Y>Z,非金属性越强,单质与氢气反应越剧烈,所以Y的单质与氢气反应较Z剧烈,故C错误;
D、X与Y形成的化合物NO不溶于水,故D错误.
故选B.
点评 本题考查位置、结构、性质的应用,Y是学生解答本题的突破口,明确短周期及元素在周期表中的位置来推断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列关于${\;}_{53}^{131}$I的说法正确的是( )
| A. | 核内质子数为131 | B. | 核内中子数为131 | C. | 原子序数为53 | D. | 质量数为53 |
2.阿伏伽德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A. | 标准状况下,4.48LCH3CH2OH中约含有1.204×1023个羟基 | |
| B. | 常温常压下,31g白磷P4和红磷P8的混合中约含有6.02×1023个磷原子 | |
| C. | 标准状况下,7.8g苯中约含有1.806×1023个碳碳双键 | |
| D. | 1molH2O2在MnO2催化作用下完全反应转移的电子数约为1.204×1024个电子 |
3.室温下,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的CH3COOH溶液中:c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的NH4Cl溶液中:c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-) |
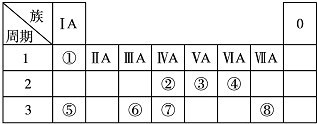
 ,
, .若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.
.若用球棍模型表示①和④形成的化合物的分子结构,应该是下图中的B.