题目内容
9.有①②③④⑤五种元素,在元素周期表中的位置如图所示.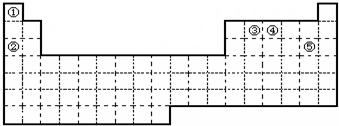
回答下列问题:
(1)这五种元素中,属于金属元素的是Na(写元素名称),该元素最高价氧化物的水化物的化学式为NaOH.
(2)元素①和③可以形成含10e-的化合物,其化学式是CH4.
(3)画出元素④的原子结构示意图
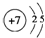 ,
,(4)比较原子半径大小:⑤>②(填“>”或“<”);写出⑤单质分子的电子式
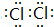 .
.
分析 根据元素在周期表中的位置,可知①为H、②为Na、③为C、④为N、⑤为Cl.
(1)同周期自左而右元素的金属性减弱,同主族自上而下元素的金属性增强,所以这几种元素中金属性最强的是Na元素;
(2)元素①和③含10e-的化合物是CH4;
(3)元素④为N,原子核外电子数为7,有2个电子层,各层电子数为2、5;
(4)同周期自左而右原子半径减小;⑤的单质为Cl2,分子中氯原子之间形成1对共用电子对.
解答 解:根据元素在周期表中的位置,可知①为H、②为Na、③为C、④为N、⑤为Cl.
(1)同周期自左而右元素的金属性减弱,同主族自上而下元素的金属性增强,所以这几种元素中金属性最强的是Na元素,该元素最高价氧化物的水化物的化学式为NaOH,
故答案为:钠;NaOH;
(2)元素①和③含10e-的化合物是CH4,故答案为:CH4;
(3)元素④为N,原子核外电子数为7,有2个电子层,各层电子数为2、5,原子结构示意图为: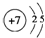 ,故答案为:
,故答案为: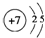 ;
;
(4)同周期自左而右原子半径减小,故原子半径②>⑤;⑤的单质为Cl2,分子中氯原子之间形成1对共用电子对,电子式为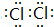 ,故答案为:>;
,故答案为:>;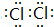 .
.
点评 本题考查元素周期表和元素周期律的综合应用,比较基础,侧重对基础知识的巩固,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1mol Cl2和HCl的混合气体所含分子总数为2NA | |
| B. | 101kPa、0℃时,22.4 L H2中氢原子数为NA个 | |
| C. | 标准状况下,2.24 L CCl4含有的碳原子数目为0.1NA | |
| D. | 常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
13.几种短周期元素的原子半径及某些化合价见下表:
分析上表中有关数据,并结合已学过的知识,回答以下问题.涉及上述元素的答案,请用元素符号表示.
(1)E元素在周期表中位于三周期ⅥA族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)F-、Na+、Al3+
(3)J单质在B单质中燃烧可生成化合物X,X的电子式是 ,其中所含的化学键类型为离子键和非极性键.
,其中所含的化学键类型为离子键和非极性键.
(4)I单质可在D的最高价氧化物中燃烧,涉及的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MaO+C.
(5)B与H所形成的化合物与J的最高价氧化物对应水化物Y的溶液发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
(1)E元素在周期表中位于三周期ⅥA族;
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)F-、Na+、Al3+
(3)J单质在B单质中燃烧可生成化合物X,X的电子式是
 ,其中所含的化学键类型为离子键和非极性键.
,其中所含的化学键类型为离子键和非极性键.(4)I单质可在D的最高价氧化物中燃烧,涉及的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MaO+C.
(5)B与H所形成的化合物与J的最高价氧化物对应水化物Y的溶液发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
10.黄铁矿的主要成分是FeS2,FeS2读作“过硫化亚铁”,它是离子化合物,其中有类似于Na2O2结构,则下列说法中正确的是( )
| A. | 与盐酸反应的化学方程式为:FeS2+2HCl═FeCl2+S↓+H2S↑ | |
| B. | 在FeS2中,硫元素的化合价与辉铜矿(主要成分是Cu2S)中硫元素的化合价相同 | |
| C. | FeS2中的Fe元素位于第4周期第ⅧB族 | |
| D. | 若FeS2在空气中燃烧时生成Fe2O3和SO2,则1mol FeS2在反应中将失去6mol e- |
14.室温下,pH相同、体积相同的醋酸和盐酸分别采取下列措施,有关叙述正确的是( )
| A. | 加入适量醋酸钠晶体后,两溶液的pH均增大 | |
| B. | 将温度升高至50℃,两溶液的pH均不变 | |
| C. | 加水稀释至原体积的2倍后,两溶液的pH均减小 | |
| D. | 加入足量锌粉充分反应后,两溶液产生氢气一样多 |
18.下列关于${\;}_{53}^{131}$I的说法正确的是( )
| A. | 核内质子数为131 | B. | 核内中子数为131 | C. | 原子序数为53 | D. | 质量数为53 |
19.下列离子方程式中正确的是( )
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-→CuS↓+H2S↑ | |
| B. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+→Fe2++2Fe3++4H2O | |
| C. | 碳酸氢铵溶液与苛性钾溶液混和共热:NH4++OH-→NH3↑+H2O | |
| D. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O→SO32-+2HClO |