题目内容
【题目】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如图:
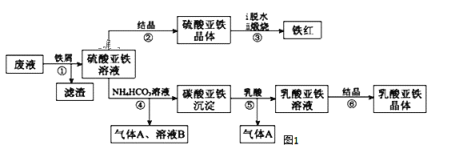
已知:乳酸可以和碳酸根生成二氧化碳气体。请回答:
(1)步骤④需控制反应温度低于35℃,其目的是___。
(2)步骤④反应的离子方程式是___。
(3)已知:FeCO3(s) Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因___。
(4)Fe3+对H2O2的分解具有催化作用。利用如图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是___。
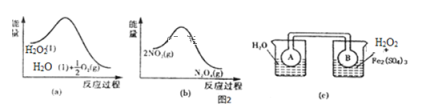
【答案】防止碳酸氢铵分解,防止亚铁离子被氧化 Fe2++2HCO3-= FeCO3↓+H2O+CO2↑ 乳酸与碳酸根离子反应,使平衡正移 深 2NO2(g)=N2O4(g)△H<0,过氧化氢分解放热,温度升高,平衡逆移
【解析】
(1)NH4HCO3受热易分解,所以步骤④需控制反应温度低于35℃;同时,温度高时,亚铁离子易被空气中的氧气氧化。
答案为:防止碳酸氢铵分解,防止亚铁离子被氧化
(2)从流程图中可以看出,步骤④是硫酸亚铁与碳酸氢铵反应,生成碳酸亚铁沉淀、二氧化碳气体等,所以反应的离子方程式为:Fe2++2HCO3-= FeCO3↓+H2O+CO2↑
答案为:Fe2++2HCO3-= FeCO3↓+H2O+CO2↑
(3)步骤⑤中,碳酸亚铁发生电离,FeCO3(s) Fe2+(aq)+CO32-(aq),乳酸与CO32-发生反应,减少了生成物浓度,促使平衡不断地正向移动,最后碳酸亚铁全部溶解,生成乳酸亚铁。答案为:乳酸与碳酸根离子反应,使平衡正移
(4)从图(a)和(b)中可以得出如下信息:双氧水的分解反应、2NO2(g)N2O4(g)都是放热反应。按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的深。答案为:深。
因为双氧水分解放热,使B瓶的温度升高,2NO2(g)=N2O4(g)的平衡逆向移动,c(NO2)增大,所以气体的颜色加深。答案:2NO2(g)=N2O4(g)△H<0,过氧化氢分解放热,温度升高,平衡逆移。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上可用![]() 与
与![]() 合成亚硝酰氯
合成亚硝酰氯![]() ,可以用于有机合成。回答下列问题:
,可以用于有机合成。回答下列问题:
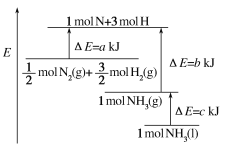
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下:
①![]()
②![]()
③![]()
则![]()
![]() __________(用
__________(用![]() 、
、![]() 表示)。
表示)。
(2)![]() 时,在一密闭容器中发生反应:
时,在一密闭容器中发生反应:![]() ,其正反应速率表达式
,其正反应速率表达式![]() 。测得正反应速率和对应浓度的数据如表:
。测得正反应速率和对应浓度的数据如表:
序号 |
|
|
① |
|
|
② |
|
|
③ |
|
|
则![]() __________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
__________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
(3)![]() 时,向体积为
时,向体积为![]() 且带气压计的恒容密闭容器中通入
且带气压计的恒容密闭容器中通入![]() 和
和![]() 发生反应:
发生反应:
![]() 。已知:反应起始和平衡时温度相同。
。已知:反应起始和平衡时温度相同。

①测得反应过程中压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则
所示,则![]() __________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强
__________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则改变的条件是_________。
所示,则改变的条件是_________。
②图2是两位同学描绘的上述反应平衡常数的对数值![]() 与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);
与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);![]() 的值为______。
的值为______。