��Ŀ����
����Ŀ���о������仯�����ת����ʵ�ʹ�ҵ�����������о�����Ҫ�����塣
��1����֪��ҵ�Ϻϳɰ�N2(g)+3H2(g)![]() 2NH3(g)�������仯��ͼ��ʾ����һ���¶��£���2 L�ĺ����ܱ�������Ͷ��2.2 mol N2��2.6 mol H2����10 min�ﵽƽ�⣬�����������ʾ��ƽ������Ϊ0.03mol��L-1��min-1
2NH3(g)�������仯��ͼ��ʾ����һ���¶��£���2 L�ĺ����ܱ�������Ͷ��2.2 mol N2��2.6 mol H2����10 min�ﵽƽ�⣬�����������ʾ��ƽ������Ϊ0.03mol��L-1��min-1
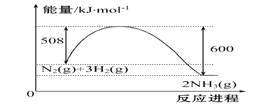
�ٸ÷�Ӧ����ЧӦ��H=______________
�ڷ�Ӧ�ﵽƽ���ų�������Ϊ__________kJ����ʱN2��ת����Ϊ___________���ڸ��¶��£���Ӧ��ƽ�ⳣ��K=__________
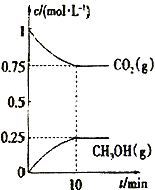
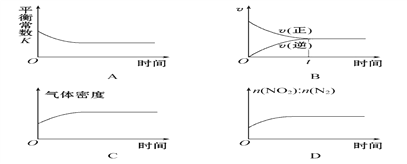
��2�����ó��ȵĻ���̿���Դ���NO2����Ӧԭ��Ϊ2C(s)+2NO2(g)![]() 2CO2(g)+N2(g)��һ���¶��£���һ�����Ļ���̿��NO2����һ�����ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________(�����)��
2CO2(g)+N2(g)��һ���¶��£���һ�����Ļ���̿��NO2����һ�����ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________(�����)��
���𰸡� -92 kJ��mol-1 18.4 9.1% 0.04 L2��mol-2 BC
����������1������ͼ��õ���Ӧ����������������92kJ�����Է�Ӧ���ʱ�Ϊ-92 kJ��mol-1��
����������ʾ��ƽ������Ϊ0.03mol��L-1��min-1�����Է�Ӧ������Ϊ0.03mol��L-1��min-1��2 L��10 min = 0.6 mol��N2(g)+3H2(g)![]() 2NH3(g) ��H=-92 kJ��mol-1����ÿ��Ӧ3mol�����ķ���Ϊ92kJ����Ӧ0.6mol�����ķ���Ϊ18.4kJ����Ӧ������Ϊ0.6mol����Ӧ�ĵ���Ϊ0.2mol��ת����Ϊ0.2��2.2��9.1%��
2NH3(g) ��H=-92 kJ��mol-1����ÿ��Ӧ3mol�����ķ���Ϊ92kJ����Ӧ0.6mol�����ķ���Ϊ18.4kJ����Ӧ������Ϊ0.6mol����Ӧ�ĵ���Ϊ0.2mol��ת����Ϊ0.2��2.2��9.1%��
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
��ʼ��2.2 2.6 0
��Ӧ��0.2 0.6 0.4
ƽ���� 2 2 0.4 ����λΪmol��
���Ե�����������������Ũ�ȷֱ�Ϊ��1mol/L��1mol/L��0.2mol/L��ƽ�ⳣ��![]() L2��mol-2��
L2��mol-2��
��2��ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ���ƽ�ⳣ��Ӧ�ò��仯������ͼ��A�������ŷ�Ӧ���У�����Ӧ���ʼ�С���淴Ӧ�����������淴Ӧ�������ʱ����Ӧ��ƽ�⣬����ͼ��B��ȷ�����ŷ�Ӧ���У�������Cת��Ϊ���壬���������������ӣ�����������䣬�����ܶ�����Ӧ��ƽ���Ժ����ʵ��������䣬�����ܶȲ��ٸı䣬ͼ��C��ȷ�����ŷ�Ӧ���У�NO2������N2�������������ߵı���Ӧ�ü�С��ͼ��D����

����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף���������˵������Ԫ�ط��š���ѧʽ�Ȼ�ѧ���
���� | IA | ��A | IIIA | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� |
��1���ڢݡ���Ԫ���У�ԭ�Ӱ뾶��С���� �� �����ӵ�ԭ�ӽṹʾ��ͼΪ �� ���Ӱ뾶������ ��
��2����ЩԪ�ص�����������Ӧ��ˮ�����У�������ǿ���� �� ������ǿ���� ��
��3��д���ݺ͢ߵ�����������Ӧˮ���ﷴӦ�����ӷ���ʽ��
��4����Ҫ��д�������������ʵĵ���ʽ���ڵ��⻯�����ݵ�һ��������ʵ���ɫ���京�еĻ�ѧ�������� �� ����ʽΪ ��
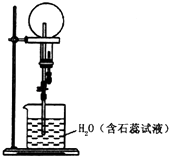
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£������кϳɲ���ش����⣺
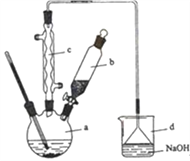
�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������_____���塣�����μ���Һ����ꡣװ��d��������________����ȡ�屽�Ļ�ѧ����ʽ____________________________��
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӡ�NaOH��Һϴ�ӵ������ǣ�______��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����_____��
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ_______________��Ҫ��һ���ᴿ�����в����б������_________(������ȷѡ��ǰ����ĸ)��
A.�ؽᾧ B.���� C.���� D.��ȡ
��4��ȡ��Ӧ���ձ��е���Һ2 mL����������ϡ�����ữ���ٵ���AgNO3��Һ����dz��ɫ��������___(�ܻ���)֤������Һ�巴����ȡ����Ӧ��Ϊʲô? _______________________��