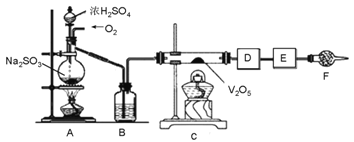
题目内容
【题目】有一含Ni的单核六配位配合物,其阳离子空间结构为八面体。1mol该配合物的稀水溶液与足量![]() 混合生成
混合生成![]() 沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为
沉淀233g;将溶液过滤,滤液与硝酸银溶液混合不生成沉淀。元素分析表明该配合物所含部分原子个数比为![]() 。
。
(1)请画出Ni的价电子排布图:______________________,H、N、O的电负性由大到小的顺序为______________________。
(2)滤液与硝酸银溶液混合不生成沉淀的原因是___________________________________。
(3)该配合物阴离子的中心原子杂化方式为____________,请写出该配合物的化学式:________________。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域![]() 键”。下列微粒中存在“离域
键”。下列微粒中存在“离域![]() 键”的是_________
键”的是_________![]() 填序号
填序号![]() 。
。
A.![]()
![]()
![]()
![]() 苯
苯
(5)如图是六方NiAs晶胞的晶胞图及坐标参数,其中![]() ,
,![]() ,
,![]() 。晶胞顶点、棱上小球为Ni,As在体内。
。晶胞顶点、棱上小球为Ni,As在体内。

①写出As的配位数为_________,Ni的配位数为_________。
②已知晶胞参数为![]() ,
,![]() ,则晶胞的密度为____________
,则晶胞的密度为____________![]() 写表达式
写表达式![]() 。
。
【答案】![]()
![]() 氯与Ni形成配位键不能解离,故不与
氯与Ni形成配位键不能解离,故不与![]() 形成沉淀
形成沉淀 ![]() 杂化
杂化 ![]()
![]()
![]() 6
6 ![]()
【解析】
![]() 的价电子排布式为
的价电子排布式为![]() ,所以排布图为
,所以排布图为![]() ;非金属性越强,电负性越大,所以电负性大小顺序为
;非金属性越强,电负性越大,所以电负性大小顺序为![]() ;
;
![]() 由于配合物中有氯,但是加硝酸银却没有现象,说明氯没有在配合物的外界形成阴离子,所以氯应该是和Ni形成了配位键,所以不与
由于配合物中有氯,但是加硝酸银却没有现象,说明氯没有在配合物的外界形成阴离子,所以氯应该是和Ni形成了配位键,所以不与![]() 形成沉淀;
形成沉淀;
![]() 根据产生硫酸钡沉淀可知阴离子为硫酸根离子,硫酸根离子中硫是
根据产生硫酸钡沉淀可知阴离子为硫酸根离子,硫酸根离子中硫是![]() 杂化;由于配合物为单核六配位配合物,其阳离子空间结构为八面体,元素分析表明该配合物所含部分原子个数比为
杂化;由于配合物为单核六配位配合物,其阳离子空间结构为八面体,元素分析表明该配合物所含部分原子个数比为![]() ,所以有6个配体,一个为氯,其余为
,所以有6个配体,一个为氯,其余为![]() ,其化学式为
,其化学式为![]() ;
;
![]() 中S和苯中的C采取
中S和苯中的C采取![]() 杂化,原子在同一平面,有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域
杂化,原子在同一平面,有相互平行的p轨道,则p电子可以在多个原子间运动,形成“离域![]() 键”,B和C中
键”,B和C中![]() 和
和![]() 的中心原子都是
的中心原子都是![]() 杂化,原子不在同一平面,不能形成“离域
杂化,原子不在同一平面,不能形成“离域![]() 键”;
键”;
答案选AD;
根据晶胞结构看出As周围最近的Ni有6个;根据化学式NiAs判断两种原子个数比为
![]() ,所以Ni的配位数也为6;一个晶胞有2个NiAs,体积为
,所以Ni的配位数也为6;一个晶胞有2个NiAs,体积为![]() ,所以密度为
,所以密度为![]() 。
。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案