题目内容
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为 4:3,Z 原子比 X 原子的核外电子数多 4。下列说法正确的是
A.W、Y、Z 的电负性大小顺序一定是 Z>Y>W
B.W、X、Y、Z 的原子半径大小顺序可能是 W>X>Y>Z
C.Y、Z 形成的分子空间构型可能是正四面体
D.WY2 分子中![]() 键与π键的数目之比是 2:1
键与π键的数目之比是 2:1
【答案】C
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,由于最外层电子数不超过8,故W的最外层电子数为4,处于第ⅣA族,X的最外层电子数为3,处于第ⅢA族,原子序数X大于W,故W为C元素,X为Al元素,Z原子比X原子的核外电子数多4,故Z的核外电子数为17,则Z为Cl元素,Y的原子序数大于铝元素,小于氯元素,故Y为Si或P或S元素,据此解答。
A.同主族自上而下电负性逐渐减弱,Y若为Si元素,则电负性C>Si,A错误;
B.同周期自左而右原子半径逐渐减小,电子层越多原子半径越大,故原子半径Al>Y>Cl>C,B错误;
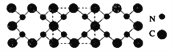
C.若Y、Z形成的分子为SiCl4,中心原子Si形成4个![]() 键,无孤电子对,为sp3杂化,正四面体构型,C正确;
键,无孤电子对,为sp3杂化,正四面体构型,C正确;
D.WY2分子为CS2,分子结构式为S=C=S,每个双键中含有1个![]() 键、1个π键,故δ键与π键的数目之比1:1,D错误。
键、1个π键,故δ键与π键的数目之比1:1,D错误。
答案选C。

练习册系列答案
相关题目