题目内容
【题目】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
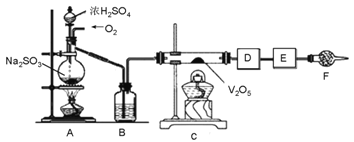
完成下列填空:
(1).A处的化学反应方程式为__________________,仪器F的名称为___________________________。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________,E:______________。

(3).用amolNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间O2,最后测得E处装置增重bg,则此时SO2的转化率为_____%(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________。
【答案】 Na2SO3+ H2SO4(浓)→ H2O + SO2↑ + Na2SO4 干燥管 ③ ④ ![]() 或
或![]() 取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质 三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸气而形成酸雾。
取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质 三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸气而形成酸雾。
【解析】根据装置图,A处烧瓶中亚硫酸钠与浓硫酸反应生成二氧化硫,反应的化学反应方程式为Na2SO3+ H2SO4(浓)= H2O + SO2↑ + Na2SO4,生成的二氧化硫与氧气在C中催化剂的作用下反应生成三氧化硫,根据题意SO3的熔点是16.8℃,沸点是44.8℃。三氧化硫容易液化,D中可以放入冰水浴装置,未反应的二氧化硫被E中的碱石灰吸收。
(1)根据上述分析,A处烧瓶中反应的化学反应方程式为Na2SO3+ H2SO4(浓)=H2O + SO2↑ + Na2SO4,仪器F为干燥管,故答案为:Na2SO3+ H2SO4(浓)= H2O + SO2↑ + Na2SO4;干燥管;
(2)根据题意SO3的熔点是16.8℃,沸点是44.8℃。三氧化硫容易液化,D中可以放入冰水浴装置,未反应的二氧化硫可以用碱石灰吸收,故答案为:③;④;
(3)根据硫原子守恒,Na2SO3~SO2~SO3,amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,应产生二氧化硫的质量为64ag,测得装置E增重了bg,即为剩余二氧化硫的质量,所以二氧化硫的转化率α=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100;
×100;
(4)亚硫酸钠容易被空气中的氧气氧化生成硫酸钠,因此检验某Na2SO3样品是否变质,只需要具有是否含有硫酸钠即可,方法为取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质,故答案为:取待测样品少许于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明该样品变质。若无白色沉淀生成,则证明该样品未变质;
(5)根据题意SO3的熔点是16.8℃,沸点是44.8℃。三氧化硫是一种易升华的固体,极易溶于水生成硫酸成大量的白雾,故答案为:三氧化硫是一种易升华的固体,在空气中三氧化硫气体易吸收水蒸气而形成酸雾。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |
【题目】I.下列是A、B、C、D、E五种短周期元素的某些性质:
性质 | A | B | C | D | E |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是____(填序号)。
a.![]() b.CH4 c.CH2
b.CH4 c.CH2![]() CHCH3d.CH3CH2C≡CH e.CH3CH3
CHCH3d.CH3CH2C≡CH e.CH3CH3
(2)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______(写化学式)
(3)B、D形成的简单氢化物,沸点:_______更高(写化学式)
II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是_______。
(2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__。
(3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。

试剂a是____;分离方法③是____。


